Introducción
El presente artículo describe la toxicocinética de las micotoxinas más importantes dentro de la patología de los animales de producción. La información expuesta brinda una visión general de las propiedades químicas de las micotoxinas y sus respectivos procesos de absorción, distribución, metabolismo y excreción en animales de producción y se profundiza en las diferencias encontradas entre las especies.
Aflatoxina
Propiedades químicas
Las aflatoxinas disponen de una estructura de cuatro anillos aromáticos, característica la cual les confiere una estructura rígida y plana. Las aflatoxinas más importantes son las B, G y la M, la cual es un metabolito de la B. La diferencia de la B con la G radica en el anillo lactona de seis. Por otro lado, la diferenciación entre la clasificación 1 y 2 radica en la oxidación del doble enlace. Referente a otros metabolitos de las aflatoxinas, el aflatoxicol (AFL) se obtiene por la oxidación grupo cetona, en la AFP1 el grupo éter se convierte en alcohol y en la AFQ1 hay un alcohol en el grupo ciclopentanona.
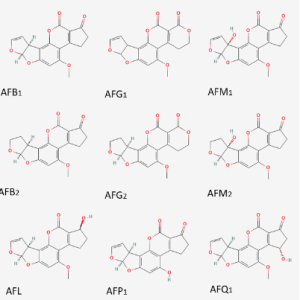
Figura 1. Estructura química de las principales aflatoxinas y sus metabolitos.
Absorción
La principal absorción de aflatoxina B1 ocurre principalmente en el intestino delgado y depende en gran medida de su peso molecular y característica lipofílica (Schrenk et.al, 2020).
Distribución
De acuerdo con la distribución, metabolismo y excreción, el órgano que principalmente se ve afectado por el efecto de las aflatoxinas es el hígado. Además, también puede acumularse en el músculo (Popescu et.al, 2022).
Metabolismo
La aflatoxina B1 es metabolizada durante su paso por el tracto gastrointestinal, pero el principal sitio donde da lugar a su extenso metabolismo aún no está dilucidado. La exposición hepática ante la aflatoxina tendrá mucha relación con la concentración de AFB1 y la tasa de absorción en intestino, además del flujo porta hepático (Schrenk et.al, 2020).
En el hígado, las aflatoxinas son substratos de las CYP monooxigenasas, incluyendo CYP3A4, 3A5 y 1A2. Un paso importante en la activación de AFB1 es la formación de AFB1-exo-8,9-epóxido, que es su forma reactiva. Solamente AFB1, AFG1 y AFM1 pueden activarse por CYPs en dicha forma reactiva. También AFB1 tiene muchos otros metabolitos que se obtienen por distintas reacciones. Por ejemplo, el Aflatoxicol es una molécula que se obtiene a partir de la reducción de AFB1 a través de una reductasa dependiente como NADPH en el hígado. Otras moléculas son: AFM1 y aflatoxina Q1 (obtenidas por hidroxilación), AFP1 (formada por el proceso de demetilación) y los productos de la oxidación (AFQ1 y AFM1). Uno de los importantes procesos enzimáticos que tiene el organismo para reducir la forma reactiva de AFB1 a un metabolito menos reactivo como el AFB1-dialcohol es dado por la familia de aldo-keto-reductasas dependientes de NADPH. De los metabolitos mencionados: AFM1, AFP1, AFQ1 y aflatoxina-dialcohol pueden ser conjugados con ácido glucurónico y excretados en las heces o la orina. A diferencia de AFB1, la información sobre el metabolismo de los otros tipos de aflatoxinas es limitada, solamente hay escasa literatura identificada del metabolismo de AFB2 (Schrenk et.al, 2020).
Excreción
La excreción de AFB1 y sus metabolitos se genera principalmente a través de la ruta biliar, seguida de la urinaria. Los animales lactantes también suelen excretar una fracción de la AFB1 ingerida en la forma de AFM1 y otros metabolitos por la leche (Eaton & Groopman, 1994).
Deoxinivalenol
Propiedades químicas
El deoxinivalenol (DON) es una micotoxina que pertenece a la familia de los tricotecenos. Los tricotecenos se caracterizan por presentar una estructura común de tres anillos y un epóxido en el carbono 12. Dentro del este grupo de compuestos existen cuatro tipos: A, B, C y D. Los tipos más frecuentes en la naturaleza son el A y B. El DON es un tricoteceno del tipo B el cual se caracteriza por presentar un grupo cetona en la posición de carbono 8.
Figura 2. Estructura química del deoxinivalenol (DON).
Absorción
La absorción intestinal y metabolismo del DON varía ampliamente en los distintos animales domésticos y dependen mucho del pH regional, de los segmentos intestinales y de la actividad bacteriana. Es la localización microbiana, lo que afecta la biodisponibilidad de DON y sus metabolitos al ser ingeridos (Knutsen, 2017). A su vez, la absorción del DON cambia de acuerdo con la especie animal, la edad e incluso el sexo. En adición, la aparición del DON en sangre después de la ingestión oral es rápida para la mayoría de las especies mamíferas (Payros et.al, 2016).
Distribución
La distribución de esta toxina ocurre en múltiples órganos, sin que su concentración sea uniforme. Tras la administración oral, el DON tiene valores elevados en plasma, hígado y riñones a los 30 minutos y posteriormente, su concentración se torna superior en el tracto intestinal después de 1 hora. Esto puede explicarse en el sentido de que DON se absorbe rápidamente en el tracto digestivo y circula brevemente en el plasma, trasladándose a múltiples órganos. Por las enzimas hepáticas, el DON se metaboliza eficientemente y se excreta por la orina, reduciendo su concentración en plasma, hígado y riñones. Con ello, el DON no absorbido, permanece en el tracto digestivo y, dado que el movimiento intestinal es mucho más lento que la circulación plasmática, se acumula. Para terminar con el tema de distribución, DON también se ha detectado a bajos niveles en el cerebro, lo que sugiere la posibilidad del traslado de esta toxina a través de la barrera hematoencefálica, ocasionando inflamación del cerebro (Sun et.al, 2022).
Metabolismo
El principal metabolismo del deoxinivalenol se centra en dos principales vías: el metabolismo de fase II y la biotransformación intestinal. El metabolismo de fase II involucra la formación de conjugados de glucósido, glucurónico y sulfato. En cambio, la biotransformación, se relaciona al paso de DON a DOM-1. El uso de ambos procesos metabólicos varía conforme a la especie. Por ejemplo, en cerdos y humanos, entre un 70 a 94% del DON se glucuroniza, mientras que una pequeña porción es detoxificada por microbiota intestinal (Sun et.al, 2022).
Sobre el metabolismo de fase II, es bastante versátil en los distintos animales. Por un lado, las aves utilizan usualmente la conjugación de sulfato, mientras que los otros animales emplean la vía de glucuronidación. Un hecho relevante es que los cerdos y los humanos comparten el metabolito DON-12GlcA (obtenido por el metabolismo de fase II), por lo cual se utiliza este animal para fines de estudio de la toxicocinética y metabolismo del humano (Sun et.al, 2022).
La transformación intestinal por bacterias de DON a DOM-1 es otra ruta importante para la detoxificación. En los pollos se sugiere que esta vía metabólica es una de las principales razones para su resistencia al DON y aunque no se dispone de amplia evidencia, estudios han confirmado que la toxina disminuye a medida que avanza por el trayecto intestinal de las aves. No obstante, DOM-1 no es el único metabolito producto de biotransformación, sino que se ha detectado la trasformación del DON en DON-3S, en pollos de engorde (Sun et.al, 2022).
Excreción
La excreción del DON y sus metabolitos en cerdos, ratones y humanos ocurre exclusivamente en la vía urinaria; a diferencia de los pollos y las ratas, donde la proporción de DON en heces puede ser superior a la encontrada en orina (Sun et.al, 2022).
Zearalenona
Propiedades químicas
La zearalenona es una micotoxina con una estructura lactona del ácido resorcicíclico. Los principales metabolitos de la zearalenona son el α y β-zearalenol que se generan por oxidación del grupo cetona a alcohol. El α y β-zearalenol son isómeros que se diferencian por la quiralidad del carbono al cual se encuentra enlazado el grupo hidroxilo.
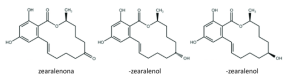
Figura 3. Estructura química de la zearalenona y sus metabolitos.
Absorción
La zearalenona parece ser una toxina con rápida y extensa absorción después de su administración oral en ratas, conejos, cerdos y humanos (EFSA, 2011). Una de las particularidades de la absorción de zearalenona es que después de ser absorbida por el intestino, parte de ZEA regresa a través de la excreción de bilis para una segunda absorción (Han et.al, 2022).
Distribución
La zearalenona y sus metabolitos pueden ser detectados tanto en los tejidos animales como sus productos. La detección de ZEA es bastante limitada en el hígado, riñón, músculo y plasma. Son sus metabolitos α y β-zearalenol los que tienen una mejor distribución. Cabe mencionar, que dichos metabolitos poseen una enorme afinidad por las albuminas por lo cual permanecen ampliamente en el plasma (Liu & Applegate, 2020). Otros de los órganos involucrados son los reproductivos (útero, testículo y ovarios) y el tejido adiposo (Han et.al, 2022).
Metabolismo
El metabolismo de zearalenona ha sido investigado tanto en animales como humanos a nivel in vivo. Son tres las rutas de biotransformación importantes reportadas en animales (EFSA, 2011).
En primer lugar, se encuentra la reducción enzimática de zearalenona catalizada por 3α y 3 β-hidroxiesteroide deshidrogenasa (HSDs), produciendo α, β-zearalenol y un reducido grupo de zearalanoles. Las formas reducidas primarias de la toxina tienen distintas actividades estrogénicas, y la reactividad tóxica tiene un orden donde -zearalenol es superior a zearalenona y β-zearalenol. En las especies mamíferas, la transformación hepática de zearalenona es notablemente diferente en cuanto a los metabolitos reducidos y glucurónidos. Por ejemplo, los cerdos transforman la zearalenona en su mayoría a -zearalenol, mientras que los bovinos la transforman en , β-zearalenol, lo que explica una mayor sensibilidad por parte del suino (EFSA, 2011).
Como segundo proceso metabólico, se encuentra la monohidroxilación. Reportado en los humanos a través del citocromo P450 (CYPs) y las microsomas hepáticas. Se generan catecoles por hidroxilación aromática y estos metabolitos posteriormente se oxidan en quinonas que a su vez desarrollan un ciclo redox y modifican de manera covalente las macromoléculas biológicas. Las propiedades estrogénicas de estos catecoles siguen siendo desconocidas (EFSA, 2011).
Como último proceso metabólico se presenta la conjugación de fase II de zearalenona y sus metabolitos reducidos con ácido glucurónico y sulfato, mediado por catalizadores como las uridindifosfato-glucoronosiltransferasas (UGTs) y sulfotransferasas (SULTs). Basado en estudios in vitro, la zearalenona y sus metabolitos se glucuronizan rápidamente en el hígado e intestino, pero también, pueden metabolizarse en órganos extrahepáticos tanto en humanos como en varias especies animales (EFSA, 2011).
Excreción
La mayoría de los mamíferos utilizan la bilis y la circulación enterohepática para la excreción de zearalenona. Los derivados glucurónidos de zearalenona se recolectan en la bilis y nuevamente se reabsorben y metabolizan en la mucosa intestinal. Este proceso de reabsorción contribuye con el tiempo de retención de ZEA en el organismo prolongando su efecto tóxico y dificultando su eliminación (Han et.al, 2022).
Ocratoxina
Propiedades químicas
Las ocratoxinas están compuestas por la unión de un grupo fenilalanina con el ácido dihidroisocumárico mediante un enlace péptico, en el cual intervienen el grupo carboxilo (-COOH) y el grupo amino (-NH2). Existen principalmente dos tipos de ocratoxinas la A y la B, las cuales se distinguen por la presencia de un grupo cloruro en la forma A. Las ocratoxinas se pueden hidrolizar obteniendo los metabolitos OTalfa y OTbeta de menor toxicidad.
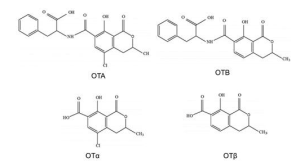
Figura 4. Estructura química de las principales ocratoxinas y sus metabolitos.
Absorción
De rápida absorción tras la ingestión oral, alcanza altos niveles en sangre por varias horas. Por difusión pasiva a través del estómago y en particular la región proximal del yeyuno se da lugar al ingreso sistémico de ocratoxina, y al mismo tiempo dicho proceso se facilita por la alta afinidad de las proteínas plasmáticas con esta toxina. La biodisponibilidad sistémica de la toxina cambia de acuerdo con la especie (Schrenk et.al, 2020).
Distribución
En lo referente a la distribución, OTA es particularmente relevante por su fuerte unión no covalente con las proteínas del suero, en especial la albúmina, lo que explica lo difícil que es su posterior eliminación y su larga vida media en el organismo. OTA tiene su distribución en todos los órganos del cuerpo, no obstante, la concentración que presente la toxina en cada órgano dependerá de la especie animal, la dosis administrada y como ha sido estudiada (diseño del estudio cinético). La mayoría de los estudios o reportes indican que altas concentraciones de OTA son expresadas frecuentemente en el riñón, seguido del hígado y músculo. Además, la redistribución y depósito de esta toxina puede ocurrir en órganos ricos en lípidos. En cuanto a la transferencia de ocratoxina por vía placentaria, el transporte es mínimo como indican ciertos estudios in vitro. Además, la evidencia sugiere que la transferencia de OTA tiene relación a medida que se desenvuelve o se desarrolla placenta. La transferencia de la toxina también puede acontecer a través de la vía uterina o por medio de la leche materna tanto en animales como humanos. Estudios en vacas lecheras, encontraron trazas de ocratoxina en leche, aludiendo que la mínima concentración de la toxina en este producto animal puede atribuirse a la eficiente degradación presistémica generada por la microflora ruminal (Schrenk et.al, 2020).
Metabolismo
El mayor metabolito de OTA es OTalfa, que se forma cuando se hidroliza el puente amida entre la fenilalanina y el ácido dihidroisocumárico. Gran parte de esta molécula se genera por la microbiota intestinal en animales no rumiantes incluyendo humanos, y por su parte, en la microbiota ruminal de vacas, ovejas y otros rumiantes. La degradación de OTA se lleva a cabo por numerosas hidrolasas, como la carboxipeptidasa A, que aparentemente es la más activa. Esta formación de OTalpha se considera el proceso importante para la detoxificación y una vez que se genera este metabolito, no se acumula en el riñón y rápidamente se excreta por la orina, como glucurónido (Schrenk et.al, 2020).
Excreción
La compleja unión de OTA con la albúmina produce que la eliminación de la toxina por filtración glomerular sea reducida. Es la secreción tubular la encargada de realizar la eliminación de OTA y de utilizar los transportadores de aniones orgánicos. Desafortunadamente, la toxina puede reabsorberse a nivel tubular y dicha acción es parcialmente responsable de su acumulación en el organismo. En adición, diversos estudios in vivo han afirmado que la toxina tiene la capacidad de reabsorberse en cualquier parte de la nefrona, utilizando el transporte activo o la difusión pasiva de acuerdo con el pH. La excreción biliar de OTA y sus metabolitos es la ruta más importante de la vía fecal. De forma similar a la vía urinaria, OTA puede absorberse nuevamente después de ser hidrolizada por la microflora bacteriana y continuar en la circulación enterohepática, con lo cual se elimina lentamente del organismo. Finalmente, existe evidencia de que OTA puede contaminar y ser excretada por la leche, donde yace una relación directa entre la ingesta de OTA y su concentración en leche (Koszegi & Poor, 2016).
Toxina T-2
Propiedades químicas
La toxina T-2 es una micotoxina que pertenece a la familia de los tricotecenos del tipo A. La toxina T-2 se caracteriza por tener dos grupos éster en los carbonos 4 y 8 de su estructura molecular. Su metabolito principal es la toxina HT-2, la cual se genera por hidrólisis del éster de posición carbono 4 a un grupo hidroxilo.
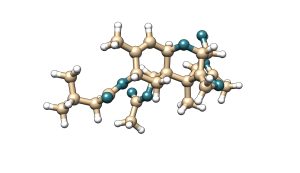
T-2
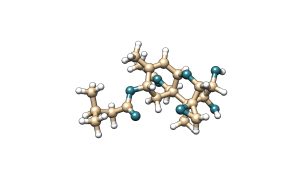
HT-2
Figura 5. Estructura química de la toxina T-2 y su metabolito principal HT-2.
Absorción
Su absorción es rápida después de la ingestión en la mayoría de las especies animales y se distribuye en el organismo con poco o ningún acúmulo sobre un órgano en específico. Es una toxina de carácter lipofílico, que además de absorberse por el tracto alimentario puede atravesar la mucosa respiratoria (Janik et.al, 2021).
Distribución
La toxina T-2 se traslada rápidamente del plasma a los tejidos u órganos, con un tiempo medio plasmático menor a 20 minutos. Se distribuye en órganos como el hígado o riñón sin acumularse de manera importante. Al mismo tiempo, T-2 tiene la capacidad de atravesar la placenta y los tejidos fetales (CONTAM, 2011).
Metabolismo
El metabolismo de la toxina T-2 tiene lugar en el intestino, hígado y otros tejidos (CONTAM, 2011). Las vías metabólicas principales de esta toxina son: hidrólisis, hidroxilación, conjugación y depoxidación. El metabolito predominante de la toxina T2 en todas las especies es el HT-2, que se obtiene a consecuencia de la hidrólisis de la toxina. Este metabolito es considerado un importante biormarcador porque con él se puede detectar la exposición de animales y humanos a la toxina T-2 (Janik et.al, 2021). La mayoría de los metabolitos y en especial la toxina T-2 son extensamente conjugados con glucurónidos, lo cual es uno de los mecanismos más relevantes de su detoxificación (CONTAM, 2011).
Excreción
El tracto urinario y biliar son las vías utilizadas para la excreción de la toxina T-2 y sus metabolitos. La excreción es rápida, con mayor proporción en las heces. Se tiene conocimiento que a nivel enterohepático ocurre un reciclaje de la toxina T-2 y sus metabolitos conjugados glucurónidos (CONTAM, 2011).
Fumonisinas
Propiedades químicas
Las fumonisinas presentan una estructura molecular similar a la de una cadena lipídica. Existen cuatro tipos de fumonisinas, siendo la B1 la de mayor toxicidad, y se diferencian entre ellas por la presencia de grupos alcohol en las posiciones 5 y 10 de la cadena. Además, presentan ramificaciones mediante ésteres en los carbonos en posición 14 y 15.
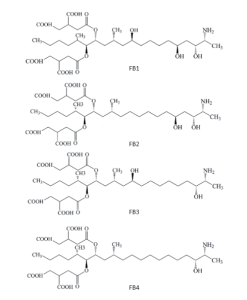
Figura 6. Estructura química de las principales fumonisinas.
Absorción
Las fumonisinas son micotoxinas que se caracterizan por su baja biodisponibilidad, debido a la carga de su estructura y la escasa expresión del receptor específico para su transporte a nivel entérico. En varias especies, los reportes indican que las fumonisinas están sujetas a una serie de reacciones hidrolíticas consecutivas que ocurren principalmente en el intestino, formando parcialmente fumonisina A y fumonisina B y finalmente HFB1 o aminopentol. En los animales expuestos, los metabolitos pueden encontrarse en el hígado, riñón y en menor cantidad el músculo (Schrenk et.al, 2022).
Distribución
En numerosas especies animales, la distribución de fumonisina B1 tras su absorción en el tracto gastrointestinal, ocurre preferentemente en el hígado, riñón y músculo. Por medio de los distintos reportes, se conoce qué hígado y riñón presentan cierta sensibilidad a la fumonisina B1, lo que puede deberse o correlacionarse a la concentración de la toxina en el tejido tras su absorción (Knutsen et.al, 2018).
Metabolismo
Los sitios primordiales para el metabolismo de las fumonisinas son el hígado y el tracto digestivo, donde las vías metabólicas fundamentales son la hidrólisis, acilación y transaminación. El metabolito principal de fumonisina B1 es HFB1 o también llamado AP1. Este se genera por la hidrólisis de las cadenas laterales del ácido tricarbálico en los carbonos 14 y 15, que luego son reemplazadas por grupos hidroxilo (Wang et.al 2015).
Excreción
La mayoría de los estudios realizados en animales experimentales y de granja reportan que tras la ingestión oral de FB1 y FB2, estos se excretan sin ningún cambio en las heces y en menor proporción en la orina. La excreción de la toxina se produce en las primeras 12 y 48 horas por la vía urinaria y fecal, respectivamente (Knutsen et.al, 2018).
En conclusión, la toxicocinética de las micotoxinas es un tema bastante complejo a medida que se investigan y se comparan las diferencias entre las toxinas y las especies animales. En general, las micotoxinas tienden a compartir los mecanismos de absorción, distribución, metabolismo y excreción; sin embargo, el modo en que utilizan las distintas rutas no es el mismo, además de variar según la especie. A pesar de la dificultad de su entendimiento, no cabe duda de que el conocer su desenvolvimiento en el organismo es importante para el desarrollo de medidas que mitiguen sus efectos en los órganos diana del cuerpo.



