Introducción
La toxicocinética es el estudio de los procesos mediante los cuales se tratan las sustancias potencialmente tóxicas en el organismo (EFSA, por sus siglas en inglés). Implica comprender cómo funciona su absorción, distribución, metabolismo y excreción (ADME). El estudio de dichos procesos en las diferentes especies animales es fundamental, así como abordar la exposición a cada micotoxina en función de su naturaleza toxicológica.
Aflatoxina
Propiedades químicas
Las aflatoxinas presentan una estructura compuesta por cuatro anillos aromáticos, lo que les confiere una estructura rígida y plana. Las micotoxinas más importantes dentro de este grupo son la aflatoxina B1, B2, G1, G2 y la M1, siendo esta última un metabolito de la primera. La diferencia entre las aflatoxinas B y G radica en la estructura de su anillo lactona de seis carbonos. Por otro lado, la diferenciación entre la clasificación 1 y 2 se basa en la oxidación de su doble enlace. Existen otros metabolitos de las aflatoxinas, como el aflatoxicol, que se genera por la oxidación del grupo cetona; la aflatoxina P1 (AFP1), en la que el grupo éter se transforma en alcohol; y la aflatoxina Q1 (AFQ1), que contiene un alcohol en el grupo ciclopentanona.
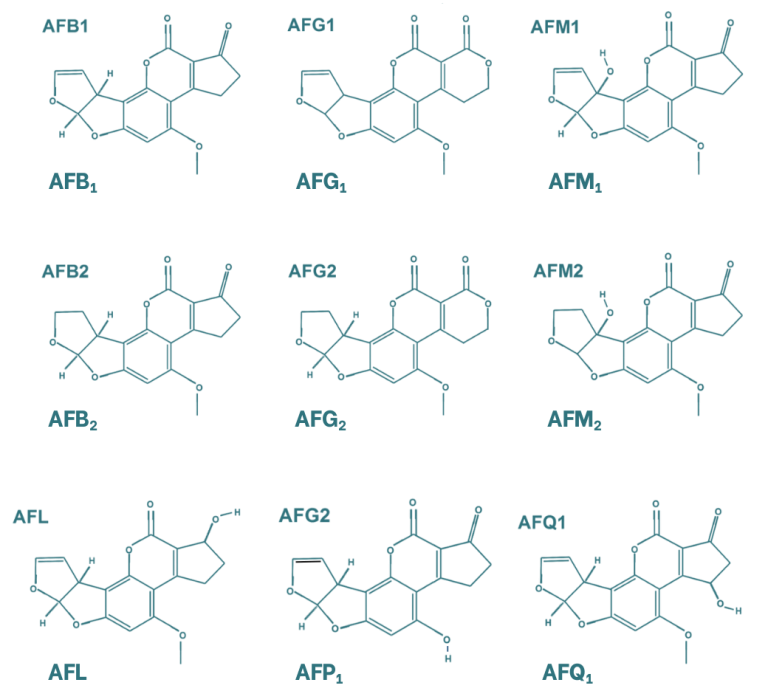
Figura 1. Estructura química de las principales aflatoxinas y sus metabolitos (Popescu et al., 2022).
Absorción
La absorción de aflatoxina B1 (AFB1) ocurre principalmente en el intestino delgado y depende en gran medida de su peso molecular y de su naturaleza lipofílica (Schrenk et al., 2020a).
Distribución
En cuanto a su distribución, el órgano principalmente afectado por las aflatoxinas es el hígado. Sin embargo, estas micotoxinas también pueden acumularse en el tejido muscular (Popescu et al., 2022).
Metabolismo
La AFB1 es metabolizada a lo largo de su paso por el tracto gastrointestinal; sin embargo, aún no se ha determinado con precisión el sitio donde ocurre su metabolismo más extenso. La exposición del hígado a esta toxina depende en gran medida de la concentración de AFB1, la tasa de absorción intestinal y el flujo sanguíneo portal hepático (Schrenk et al., 2020a).
En el hígado, las aflatoxinas actúan como sustratos de las CYP monooxigenasas, incluyendo CYP3A4, 3A5 y 1A2. Un paso importante en la activación de la AFB1 es la formación de AFB1-exo-8,9-epóxido (AFBO), su forma reactiva.
Por otro lado, la AFB1 puede generar varios metabolitos a través de distintas reacciones. Uno de ellos es el aflatoxicol, que se produce mediante la reducción de AFB1 por una reductasa dependiente como NADPH en el hígado. Otros metabolitos son la aflatoxina M1 (AFM1) y la AFQ1, obtenidas por hidroxilación; o la AFP1, formada por el proceso de desmetilación.
Uno de los procesos enzimáticos importantes que tienen lugar en el organismo para reducir la forma reactiva de AFB1 a un metabolito menos reactivo, como el AFB1-dialcohol, es el que implica a la familia de las aldo-keto-reductasas dependientes de NADPH. De los metabolitos mencionados: AFM1, AFP1, AFQ1 y aflatoxina-dialcohol pueden ser conjugados con ácido glucurónico y excretados en las heces o la orina. A diferencia de AFB1, la información sobre el metabolismo de los otros tipos de aflatoxinas es limitada, solamente hay escasa literatura identificada del metabolismo de AFB2 (Schrenk et al., 2020a).
Excreción
La excreción de AFB1 y sus metabolitos se produce principalmente a través de la ruta biliar, seguida de la urinaria. Las hembras en período de lactancia también suelen excretar una fracción de la AFB1 ingerida en forma de AFM1, junto con otros metabolitos, a través de la leche (Eaton et al., 1994).
Deoxinivalenol
Propiedades químicas
El deoxinivalenol (DON) es una micotoxina que pertenece a la familia de los tricotecenos, que se caracteriza por presentar una estructura común de tres anillos y un epóxido en el carbono 12. Dentro de este grupo de compuestos existen cuatro tipos: A, B, C y D. Los tipos más frecuentes en la naturaleza son el A y B. El DON es un tricoteceno del tipo B, que se caracteriza por presentar un grupo cetona en la posición de carbono 8.
Figura 2. Estructura química del DON.
Absorción
La absorción intestinal y el metabolismo del DON varían ampliamente entre las distintas especies animales y dependen en gran medida del pH regional, de los segmentos intestinales y de la actividad bacteriana. La localización microbiana influye significativamente en la biodisponibilidad del DON y sus metabolitos al ser ingeridos (Knutsen et al., 2017). A su vez, la absorción del DON cambia de acuerdo con la especie animal, la edad e incluso el sexo. Por otro lado, se conoce que, en la mayoría de las especies mamíferas, la aparición de DON en sangre después de la ingestión oral es rápida (Payros et al., 2016).
Distribución
La distribución de esta toxina ocurre en múltiples órganos, sin que su concentración sea uniforme. Tras la administración oral, se observan valores elevados de DON en plasma, hígado y riñones a los 30 minutos; posteriormente, su concentración se aumenta en el tracto intestinal después de 1 hora. Esto se explica porque el DON se absorbe rápidamente en el tracto digestivo y circula brevemente en el plasma, trasladándose a múltiples órganos. Por las enzimas hepáticas, el DON se metaboliza eficientemente y se excreta por la orina, reduciendo su concentración en plasma, hígado y riñones. Sin embargo, el DON no absorbido, permanece en el tracto digestivo y, dado que el movimiento intestinal es mucho más lento que la circulación plasmática, se acumula. Finalmente, el DON también se ha detectado a bajos niveles en el cerebro, lo que sugiere que esta toxina puede atravesar la barrera hematoencefálica y causar inflamación cerebral (Sun et al., 2022).
Metabolismo
El metabolismo del DON se centra en dos principales vías: el metabolismo de fase II y la biotransformación intestinal. El metabolismo de fase II involucra la formación de conjugados de glucósido, glucurónico y sulfato. En cambio, la biotransformación, se relaciona con el paso de DON a deepoxi-DON (DOM-1). El uso de ambos procesos metabólicos varía conforme a la especie. Por ejemplo, en cerdos y humanos, entre un 70 y un 94% del DON se glucuroniza, mientras que una pequeña porción es detoxificada por la microbiota intestinal (Sun et al., 2022).
Sobre el metabolismo de fase II, es bastante versátil en los distintos animales. Por un lado, las aves utilizan usualmente la conjugación de sulfato, mientras que los otros animales emplean la vía de glucuronidación. Un hecho relevante es que los cerdos y los humanos comparten el metabolito DON-12GlcA (obtenido por el metabolismo de fase II), motivo por lo cual se utiliza el ganado porcino para estudios de toxicocinética y metabolismo en humanos (Sun et al., 2022).
La transformación intestinal del DON en DOM-1 por acción de bacterias constituye una vía importante de detoxificación. En los pollos de engorde se sugiere que esta vía es una de las razones por las que presentan una mayor resistencia al DON, en comparación con otras especies. No obstante, DOM-1 no es el único metabolito producto de la biotransformación en esta especie, sino que se ha detectado la transformación a DON-3S (Sun et al., 2022).
Excreción
La excreción del DON y sus metabolitos en cerdos, ratones y humanos ocurre exclusivamente a través de la vía urinaria; a diferencia de los pollos y las ratas, donde la proporción de DON en heces puede ser superior a la encontrada en orina (Sun et al., 2022).
Zearalenona
Propiedades químicas
La zearalenona (ZEA) es una micotoxina de naturaleza estrogénica con una estructura lactona del ácido resorcicíclico. Los principales metabolitos de la zearalenona son el α y β-zearalenol que se generan por la oxidación del grupo cetona a alcohol. Estos metabolitos son isómeros que se diferencian por la quiralidad del carbono al cual se encuentra enlazado el grupo hidroxilo.
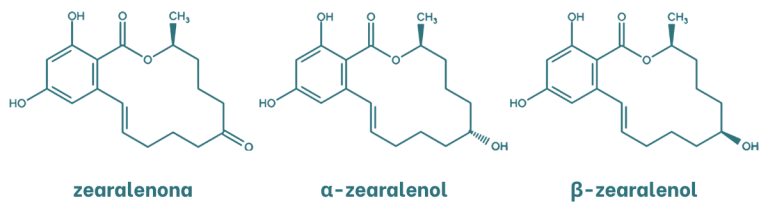
Figura 3. Estructura química de la zearalenona y sus metabolitos.
Absorción
La ZEA es una toxina con rápida y extensa absorción después de su administración oral en ratas, conejos, cerdos y humanos (EFSA, 2011). Una de las particularidades de la absorción de esta micotoxina radica en que después de ser absorbida en el intestino, parte de la misma regresa a través de la excreción de bilis para una segunda absorción (Han et al., 2022).
Distribución
La ZEA y sus metabolitos pueden ser detectados tanto en los tejidos animales como en sus productos. La detección de esta micotoxina es bastante limitada en el hígado, riñón, músculo y plasma; sin embargo, son sus metabolitos α y β-zearalenol los que tienen una distribución más amplia. Cabe mencionar, que dichos metabolitos poseen una enorme afinidad por las albuminas, lo que hace que permanezcan en el plasma durante más tiempo (Liu et al., 2020). Los principales órganos afectados por la ZEA y sus metabolitos son los de tipo reproductivo (útero, testículo y ovarios), así como el tejido adiposo (Han et al., 2022).
Metabolismo
El metabolismo de la ZEA ha sido ampliamente investigado tanto en animales a nivel in vivo. Son tres las rutas de biotransformación de esta micotoxina reportadas en las diferentes especies (EFSA, 2011).
En primer lugar, se encuentra la reducción enzimática catalizada por 3α y 3 β-hidroxiesteroide deshidrogenasa, produciendo α, β-zearalenol y un reducido grupo de zearalanoles. Las formas reducidas primarias de la toxina tienen distintas actividades estrogénicas. En las especies mamíferas, la transformación hepática de zearalenona es notablemente diferente en cuanto a los metabolitos reducidos y glucurónidos. Por ejemplo, los cerdos transforman la zearalenona en su mayoría a α-zearalenol, mientras que los bovinos la transforman en β-zearalenol, lo que explica una mayor sensibilidad a la ZEA por parte del ganado porcino (EFSA, 2011).
Como segundo proceso metabólico, se encuentra la monohidroxilación. Reportado en los humanos a través del citocromo P450 y las microsomas hepáticas. Se generan catecoles por hidroxilación aromática y estos metabolitos posteriormente se oxidan en quinonas, que a su vez desarrollan un ciclo redox y modifican de manera covalente las macromoléculas biológicas. Las propiedades estrogénicas de estos catecoles siguen siendo desconocidas (EFSA, 2011).
Como último proceso metabólico se presenta la conjugación de fase II de la ZEA y sus metabolitos reducidos con ácido glucurónico y sulfato, mediado por catalizadores como las uridindifosfato-glucoronosiltransferasas y sulfotransferasas. Basado en estudios in vitro, la ZEA y sus metabolitos se glucuronizan rápidamente en el hígado e intestino, pero también, pueden metabolizarse en órganos extrahepáticos tanto en humanos como en varias especies animales (EFSA, 2011).
Excreción
La mayoría de los mamíferos utilizan la bilis y la circulación enterohepática para la excreción de ZEA. Los derivados glucurónidos de esta micotoxina se recolectan en la bilis y nuevamente se reabsorben y metabolizan en la mucosa intestinal. Este proceso de reabsorción contribuye en la retención de la ZEA en el organismo, lo que prolonga su efecto tóxico en los animales y dificulta su eliminación (Han et al., 2022).
Ocratoxina A
Propiedades químicas
Las ocratoxinas están compuestas por la unión de un grupo fenilalanina con el ácido dihidroisocumárico mediante un enlace péptico, en el cual intervienen el grupo carboxilo (-COOH) y el grupo amino (-NH2). Existen principalmente dos tipos de ocratoxinas, A y B, las cuales se distinguen por la presencia de un grupo cloruro en la forma A. Las ocratoxinas se pueden hidrolizar obteniendo los metabolitos OTα y OTβ, que presentan menor toxicidad.
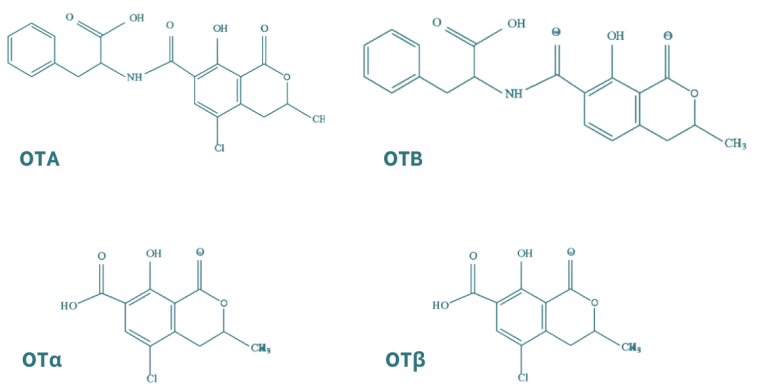
Figura 4. Estructura química de las principales ocratoxinas y sus metabolitos (Martínez et al., 2018).
Absorción
Estas micotoxinas son absorbidas rápidamente tras la ingestión oral, alcanzando altos niveles en sangre durante varias horas. La ocratoxina A (OTA) accede a la circulación sistémica por difusión pasiva, a través del estómago y, en particular, de la región proximal del yeyuno. Dicho proceso se facilita por la alta afinidad de las proteínas plasmáticas con esta toxina. Por otro lado, la biodisponibilidad sistémica de la toxina cambia de acuerdo con la especie (Schrenk et al., 2020b).
Distribución
En lo referente a la distribución, OTA es particularmente relevante por su fuerte unión no covalente con las proteínas del suero, en especial la albúmina, lo que explica lo difícil que es su posterior eliminación y su larga vida media en el organismo. OTA es distribuida a todos los órganos del cuerpo, no obstante, la concentración que presenta esta toxina en cada órgano depende de la especie animal y la dosis administrada, entre otros factores. La mayoría de los estudios o reportes indican que altas concentraciones de OTA son expresadas frecuentemente en el riñón, seguido del hígado y músculo. Además, la redistribución y depósito de esta toxina puede ocurrir en órganos ricos en lípidos.
En cuanto a su transferencia por vía placentaria, estudios in vitro indican que el transporte es mínimo. Además, la evidencia sugiere que la transferencia de OTA se produce a medida que se desenvuelve o se desarrolla la placenta. La transferencia de esta toxina también puede acontecer a través de la vía uterina o por medio de la leche materna, tanto en animales como en humanos. Estudios en vacas lecheras, encontraron trazas de OTA en leche, aludiendo que la mínima concentración de la toxina en este producto animal puede atribuirse a la eficiente degradación presistémica generada por la microflora ruminal (Schrenk et al., 2020b).
Metabolismo
El mayor metabolito de OTA es OTα, que se forma cuando se hidroliza el puente amida entre la fenilalanina y el ácido dihidroisocumárico. Esta molécula es generada por el microbiota intestinal en animales no rumiantes, incluyendo humanos, y por la microbiota ruminal de vacas, ovejas y otros rumiantes. La degradación de OTA se lleva a cabo por numerosas hidrolasas, como la carboxipeptidasa A, que aparentemente es la más activa. Esta formación de OTα se considera un proceso importante para la detoxificación, ya que una vez que se genera este metabolito, no se acumula en el riñón y rápidamente se excreta por la orina, como glucurónido (Schrenk et al., 2020b).
Excreción
La compleja unión de OTA con la albúmina hace que la eliminación de esta toxina por filtración glomerular sea reducida. Es la secreción tubular la encargada de realizar la eliminación de OTA y de utilizar los transportadores de aniones orgánicos. Sin embargo, la toxina puede reabsorberse a este nivel, y dicha acción es parcialmente responsable de su acumulación en el organismo.
Por otro lado, diversos estudios in vivo han afirmado que la toxina tiene la capacidad de reabsorberse en cualquier parte de la nefrona, utilizando el transporte activo o la difusión pasiva de acuerdo con el pH. La excreción biliar de OTA y sus metabolitos es la ruta de eliminación. De forma similar a la vía urinaria, OTA puede absorberse nuevamente después de ser hidrolizada por la microflora bacteriana y continuar en la circulación enterohepática, con lo cual se elimina lentamente del organismo. Finalmente, existe evidencia de que OTA puede ser excretada a través de la leche, habiendo una relación directa entre la ingesta de OTA y su concentración en leche (Kőszegi et al., 2016).
Toxina T-2
Propiedades químicas
La toxina T-2 es una micotoxina que pertenece a la familia de los tricotecenos del tipo A. Esta micotoxina se caracteriza por tener dos grupos éster en los carbonos 4 y 8 de su estructura molecular. Su metabolito principal es la toxina HT-2, la cual se genera por hidrólisis del éster de posición carbono 4 a un grupo hidroxilo.
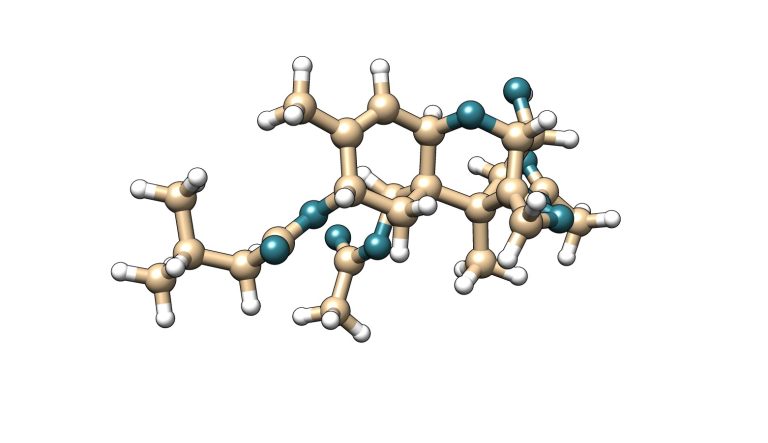
T-2
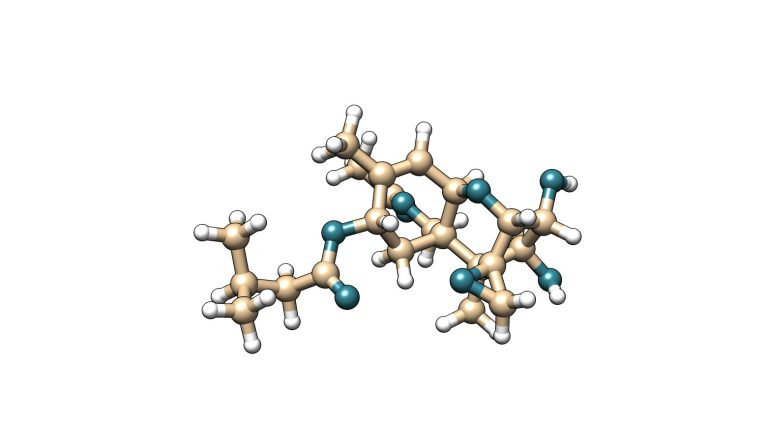
HT-2
Figura 5. Estructura química de la toxina T-2 y su metabolito principal HT-2.
Absorción
Tras la ingesta del alimento contaminado la absorción de la toxina T-2 es rápida en la mayoría de las especies animales. Además, esta micotoxina se distribuye en el organismo con poco o ningún acúmulo en los diferentes órganos y tejidos. Es una toxina de carácter lipofílico, que además de absorberse por el tracto gastrointestinal puede atravesar la mucosa respiratoria (Janik-Karpinska et al., 2022).
Distribución
La toxina T-2 se traslada rápidamente del plasma a los tejidos u órganos, con un tiempo medio plasmático menor a 20 minutos. Se distribuye en órganos como el hígado o riñón sin acumularse de manera importante. Al mismo tiempo, la T-2 tiene la capacidad de atravesar la placenta y los tejidos fetales (CONTAM, 2011).
Metabolismo
El metabolismo de la toxina T-2 tiene lugar en el intestino, hígado y otros tejidos (CONTAM, 2011). Siendo las vías metabólicas principales de esta toxina:
- La hidrólisis
- La hidroxilación
- La conjugación
- La deepoxidación
El metabolito predominante de la toxina T-2 en todas las especies es el HT-2, que se obtiene a partir de su hidrólisis. Dicho metabolito es considerado un importante biomarcador, ya que a través de su medición se puede detectar la exposición de animales y humanos a la toxina T-2 (Janik-Karpinska et al., 2022). La mayoría de los metabolitos y, en especial la toxina T-2, son extensamente conjugadas con glucurónidos, el cual es uno de los mecanismos más relevantes de su detoxificación (CONTAM, 2011).
Excreción
El tracto urinario y biliar son las vías utilizadas para la excreción de la toxina T-2 y sus metabolitos. La excreción es rápida, con mayor proporción en las heces. Por otro lado, ha sido reportado que a nivel enterohepático ocurre un reciclaje de la toxina T-2 y sus metabolitos conjugados glucurónidos (CONTAM, 2011).
Fumonisinas
Propiedades químicas
Las fumonisinas presentan una estructura molecular similar a la de una cadena lipídica. Existen cuatro tipos de fumonisinas, diferenciadas entre ellas por la presencia de grupos alcohol en las posiciones 5 y 10 de la cadena. Dentro de este grupo la fumonisina B1 (FB1) es la que genera una mayor toxicidad. Además, este tipo de micotoxinas presentan ramificaciones mediante ésteres en los carbonos de posición 14 y 15.
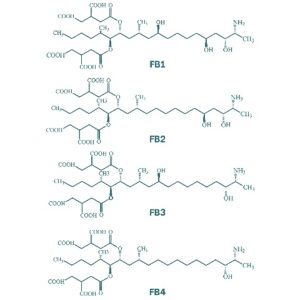
Figura 6. Estructura química de las principales fumonisinas (Kostić et al., 2019).
Absorción
Las fumonisinas son micotoxinas que se caracterizan por su baja biodisponibilidad, debido a la elevada carga de su estructura y a la escasa expresión del receptor específico para su transporte a nivel entérico. En varias especies, los reportes indican que las fumonisinas están sujetas a una serie de reacciones hidrolíticas consecutivas que ocurren principalmente en el intestino, formando parcialmente fumonisina A y fumonisina B, y finalmente HFB1 o aminopentol. En los animales expuestos, los metabolitos pueden encontrarse en el hígado, riñón y, en menor cantidad, el músculo (Schrenk et al., 2022).
Distribución
La distribución de la FB1 tras su absorción en el tracto gastrointestinal, ocurre preferentemente en el hígado, riñón y músculo. Se conoce que hígado y riñón presentan cierta sensibilidad a esta micotoxina, lo que puede correlacionarse con la concentración de la toxina en dichos órganos tras su absorción (Knutsen et al., 2018).
Metabolismo
Los sitios primordiales para el metabolismo de las fumonisinas son el hígado y el tracto digestivo, donde las vías metabólicas fundamentales son hidrólisis, acilación y transaminación. El metabolito principal de FB1 es HFB1 o también llamado AP1. Este se genera por la hidrólisis de las cadenas laterales del ácido tricarbálico en los carbonos 14 y 15, que luego son reemplazadas por grupos hidroxilo (Wang et al., 2015).
Excreción
La mayoría de los estudios realizados en animales experimentales y de granja reportan que tras la ingestión oral de FB1 y FB2, estas se excretan sin ningún cambio por vía fecal y, en menor proporción, a través de la vía urinaria. Además, la excreción de estas toxinas se produce en las primeras 12 y 48 horas (Knutsen et al., 2018).
Conclusión
La toxicocinética de las micotoxinas presenta una gran complejidad y variabilidad según el compuesto y la especie animal. Es por ello que comprender sus procesos de absorción, distribución, metabolismo y excreción es fundamental para diseñar estrategias efectivas que minimicen su impacto tóxico en los órganos diana y protejan la salud animal y humana.


