Introducción
De igual forma que las micotoxinas son altamente tóxicas para los animales, estos compuestos son una amenaza para la salud humana. Su elevada toxicidad es especialmente peligrosa para niños, embarazadas y personas con sistemas inmunológicos debilitados, lo que convierte su control en una prioridad para la seguridad alimentaria.
Existen diferentes vías de exposición, se conoce que cuando estas toxinas son ingeridas directamente por el consumidor dan lugar a una micotoxicosis primaria. Mientras que en otros casos, el consumidor puede padecer esta intoxicación debido al consumo de productos de origen animal contaminados (ej. carne, leche o huevos), lo que se denomina micotoxicosis secundaria (Figura 1).
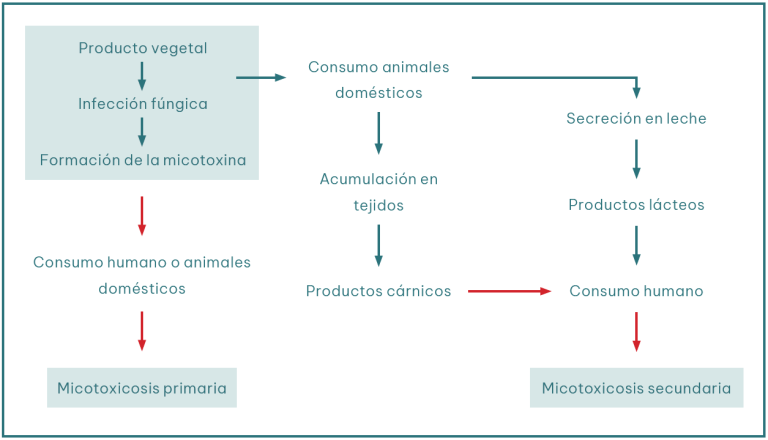
Figura 1. Diferencias entre micotoxicosis primaria y secundaria (Adaptada de Bhat, 1997 y Sanchís et al., 2004).
Una vez ingeridas, estas micotoxinas experimentan los procesos de toxicocinética que incluyen:
- Absorción
- Distribución
- Biotransformación
- Excreción
La importancia de estos procesos en el caso de los animales, radica en que también puede producirse la transferencia de estos metabolitos de las micotoxinas a productos de origen animal.
Dicho paso, en el que estos compuestos no deseados llegan a los tejidos o productos animales comestibles, se conoce comúnmente como carry-over (Völkel et al., 2011).
Las micotoxinas que han recibido mayor atención debido a la transferencia desde los piensos a los productos de origen animal son las aflatoxinas (AFB1 y AFM1), la ocratoxina A (OTA), la zearalenona (ZEA), las fumonisinas (FBs), la toxina T-2 (T-2), y la toxina HT-2 (HT-2) (Tabla 1; Tolosa et al., 2021).
| Micotoxinas | Matriz | Hongos |
|---|---|---|
AFB1, AFB2, AFG1, AFG2
AFM1 | Maíz cacahuetes, especias, frutos secos
Leche, huevos, queso | Aspergillus flavus, Aspergillus parasiticus
|
| OTA | Trigo, cebada, maíz, café, vino, cerveza | Aspergillus ochraceus, Aspergillus carbonarius, Aspergillus niger, Penicillium verrucosum |
| DON (deoxinivalenol) | Trigo, cebada, maíz | Fusarium graminearum, Fusarium culmorum |
| T-2, HT-2 | Trigo, maíz, cebada, centeno | Fusarium sporotrichioides, Fusarium poae |
| ZEA | Trigo, maíz | Fusarium graminearum, Fusarium culmorum, Fusarium crookwellense |
| FBs | Trigo | Fusarium moniliforme, Fusarium proliferatum |
Tabla 1. Principales micotoxinas en los alimentos y piensos para consumo humano y animal y sus hongos productores (Tolosa et al., 2021).
Micotoxinas en los productos de origen animal
La presencia de las micotoxinas en los productos de origen animal, junto con los agentes víricos y bacterianos, representan unas de las mayores amenazas para la seguridad, higiene y calidad de los alimentos de consumo humano. A continuación, se enumeran las matrices que pueden sufrir contaminación por estos compuestos.
Huevos
La ingestión de piensos contaminados con micotoxinas por parte de las gallinas ponedoras causa varios problemas de salud, lo que conlleva grandes pérdidas económicas en términos de calidad y cantidad de huevos.
Las micotoxinas comunes que se encuentran en los huevos son las aflatoxinas, OTA, ZEA y fumonisinas (Greco et al., 2014; Jia et al., 2016). Además, algunos autores han mostrado la presencia de enniatina B1 (ENN B1) en estos productos de consumo humano (Jestoi, 2008).
Carne y derivados
Al igual que la leche, la carne y sus derivados pueden presentar contaminaciones por carry-over. En este sentido, los estudios que se han llevado a cabo para evaluar la presencia de micotoxinas en esta categoría de productos indican que, en carne fresca y órganos animales, las toxinas más prevalentes son las aflatoxinas, OTA, fumonisinas y ZEA (Meucci et al., 2019; Hort et al., 2020). En cambio, las micotoxinas más frecuentemente reportadas en productos cárnicos curados y fermentados son OTA y las aflatoxinas.
La contaminación por aflatoxinas en carne y derivados ha sido ampliamente estudiada, especialmente en ganado porcino y aves de corral, ya que estas especies se consideran entre las más susceptibles a los efectos de las micotoxinas. Esta mayor susceptibilidad se asocia a la estructura del sistema digestivo simple y no especializado de estas especies, que permite que muchas de estas toxinas se absorban en su forma activa, generando una elevada toxicidad.
Por el contrario, los niveles de carry-over descritos en rumiantes suelen ser inferiores a los hallados en monogástricos, gracias a los procesos de detoxificación que ocurren tanto en el rumen como a nivel hepático (Tolosa et al., 2021).
No obstante, una mayor susceptibilidad biológica no implica necesariamente concentraciones elevadas en los productos comestibles. En porcinos, las concentraciones de aflatoxinas detectadas en productos cárnicos son generalmente bajas, debido a su metabolismo hepático. En aves de corral, se ha descrito la metabolización de estas micotoxinas a aflatoxicol en el hígado, metabolito que no representa una amenaza para la salud humana (Tolosa et al., 2021). Cabe destacar que la OTA constituye una de las micotoxinas más importantes en cerdos, ya que es frecuentemente detectada en tejidos comestibles y subproductos porcinos (Stoev et al., 2002).
Respecto al resto de micotoxinas, la ZEA y su metabolito α-zearalenol (α-ZEL) han sido detectados en hígados y carne de cerdo (Pleadin et al., 2015). Además, es necesario señalar la presencia de FB1 y FB2 en embutidos e hígados de cerdo (Zhao et al., 2015).
En cuanto a la presencia de las micotoxinas emergentes en la carne, estas han sido detectadas en tejidos de pavos y pollos, detectándose principalmente la enniatina (ENN) y sus metabolitos en el suero y el hígado de pollos de engorde (Křížová et al., 2021).
Leche
Uno de los casos más estudiados de carry-over es quizás el del metabolito hidroxilado AFM1, que procede de la AFB1 y se encuentra muy a menudo en la leche y sus derivados (Gonçalves et al., 2020; Tolosa et al., 2021). Se han demostrado ampliamente los efectos tóxicos de las aflatoxinas y sus metabolitos, que afectan tanto a las especies animales como a los seres humanos, destacando su efecto carcinogénico. Además, un punto importante en relación a la presencia de AFM1 en la leche, es su elevada termoestabilidad, ya que este metabolito resulta altamente resistente al uso de tratamientos térmicos como el UHT (Ulltra High Temperature) o la pasteurización (Mohamadi et al., 2010).
Siguiendo con los metabolitos encontrados en la leche y sus derivados, aunque en menor medida, se ha detectado la forma convertida de la OTA por la microbiota ruminal, conocida como OTα (Hashimoto et al., 2016).
Se ha descrito la presencia en la leche y sus derivados de otras micotoxinas, como fumonisinas, ZEA y DON (Becker-Algeri et al., 2016). Respecto a las fumonisinas, los estudios que se han llevado a cabo indican que esta micotoxina y sus metabolitos presentan una baja transferencia (Flores-Flores et al., 2015).
Del mismo modo, la ZEA ha sido detectada tanto en leche fresca como en leche en polvo, aunque no representa un peligro para la salud humana ya que las concentraciones detectadas han sido muy bajas (Flores-Flores et al., 2015; Huang et al., 2014). Por lo que concierne al DON, en la leche y derivados solo se ha detectado su forma menos tóxica, el deepoxi-DON (DOM-1) (Tolosa et al., 2021).
Cabe destacar que en los últimos años se han detectado en leche micotoxinas emergentes y modificadas, como la beauvericina (BEA) y las enniatinas. Por ejemplo, se han detectado bajos niveles de enniatinas en muestras de leche en ovejas (Piątkowska et al., 2018). Asimismo, el carry-over de dichas micotoxinas ha sido confirmado en estudios de leche humana. Sin embargo, a diferencia de otras micotoxinas, estas no han sido detectadas en leche de vaca (Křížová et al., 2021).
Pescado
El carry-over de las micotoxinas en la acuicultura no está tan estudiado como en otros productos. Sin embargo, se han estudiado las principales micotoxinas de interés para el sector, y se conoce que los órganos de los peces que presentan una concentración más alta de micotoxinas son el hígado, los riñones y los músculos comestibles (Tolosa et al., 2021).
Por ejemplo, en el salmón atlántico (Salmo salar) el carry-over del DON a los músculos y riñones es muy significativo en comparación a la dorada (Sparus aurata), donde es nulo (Pietsch et al., 2014; Nácher-Mestre et al., 2015). Por otro lado, el mismo salmón atlántico no presenta carry-over de ZEA ni sus metabolitos en los músculos, pero la trucha arcoíris (Oncorhynchus mykiss) acumula esta micotoxina tanto en el intestino como en el hígado y los ovarios (Nácher-Mestre et al., 2020).
Respecto a las micotoxinas emergentes, distintos estudios han resaltado la presencia de las enniatinas en peces de cultivo, como por ejemplo la lubina (Dicentrarchus labrax) y la dorada (Sparus aurata), particularmente en los músculos e hígado (Tolosa et al., 2014).
Conclusión
El carry-over de las micotoxinas en productos de origen animal representa un problema importante que puede afectar a la seguridad y calidad de los alimentos y, en consecuencia, la salud humana y animal. La determinación de niveles de exposición seguros a las micotoxinas, junto con la implementación de buenas prácticas agrícolas y de fabricación de piensos, son factores clave para reducir y prevenir la contaminación por las micotoxinas. De esta forma, se puede prevenir la transferencia de estos metabolitos secundarios en los productos de origen animal, y proteger la salud del consumidor.


