Las micotoxinas son compuestos naturales producidos como metabolitos secundarios por hongos filamentosos, principalmente por especies como Aspergillus, Penicillium y Fusarium, de una manera específica por cada cepa (Egbuta et al., 2017). Estas micotoxinas contaminan alrededor del 25% de los cultivos de alimentos a nivel mundial, aunque la tasa de contaminación actual puede variar entre el 60% y el 80% para algunas micotoxinas, dependiendo de varios factores como el tipo de cultivo y la micotoxina específica (Eskola et al., 2019).
Los hongos productores de micotoxinas se dividen en dos categorias: hongos de campo (por ejemplo: Fusarium spp.), que infecta los cultivos durante el crecimiento de las plantas; y hongos de almacenamiento (por ejemplo: Aspergillus spp., Penicillium spp.), que, principalmente, contaminan los cultivos después de la cosecha. Detectar estos hongos en el alimento o materia prima no garantiza que no haya contaminación por micotoxinas. Múltiples factores como la cepa del hongo, la composición del sustrato, los niveles de humedad, la ventilación y las condiciones de almacenamiento influencian la producción de estos metabolitos tóxicos. Normalmente, los climas cálidos y húmedos son los más propensos para la proliferación de hongos productores de micotoxinas (Saad et al., 2016).
Micotoxinas en alimentos para especies acuáticas
La contaminación por micotoxinas en los alimentos para acuicultura puede ocurrir antes o después de la cosecha, especialmente en cultivos con alto contenido de salvado o fibra y un alto porcentaje alto de humedad. El almacenamiento poscosecha en condiciones inadecuadas, con mayor temperatura y actividad del agua, también puede promover la producción de micotoxinas (Saad et al., 2016). Actualmente, no existen métodos para eliminar completamente las micotoxinas una vez que contaminan el alimento, pero algunas técnicas de procesamiento que utilizan temperaturas más altas pueden ayudar a reducir los niveles (Bullerman et al., 2016).
El uso de ingredientes de origen vegetal en los alimentos acuícolas va en aumento. Sin embargo, estos ingredientes suelen estar contaminados con hongos productores de micotoxinas, en particular Aspergillus flavus y Aspergillus parasiticus, que están muy extendidos (Marijani et al., 2019). Se han encontrado ejemplos de contaminación por micotoxinas en varios países, entre ellos Serbia, Brasil, Malasia y Portugal, en ingredientes como maíz, trigo, cebada y salvado de soja, entre otros (Gonçalves-Nunes et al., 2016).
Estas micotoxinas que se encuentran en los ingredientes de los piensos también se han detectado en los piensos acuícolas terminados. Por ejemplo, en Brasil, se detectaron aflatoxina B1 y fumonisinas en piensos comerciales (Hashimoto et al., 2016). En Nigeria, se encontró aflatoxina B1 en alimentos para especies acuáticas formulados localmente, mientras que Egipto detectó aflatoxina B1 y ocratoxina A en muestras de alimentos (Kholife et al., 2016). También se han localizado micotoxinas en muestras de alimentos para peces de varias regiones, y los alimentos elaborados en granjas se ven más comúnmente afectados en los países en desarrollo (Mwihia et al., 2018).
La contaminación por micotoxinas en los piensos para acuicultura es un problema generalizado que varía según la región. Las aflatoxinas son comunes en el sur de Europa, África, el sur de Asia y el sudeste asiático, mientras que el deoxinivalenol es más frecuente en América del Norte, Europa septentrional y central, África y el norte de Asia. La contaminación por zearalenona es mayor en América del Norte y del Sur, Europa central, África y el norte y sudeste de Asia. Las fumonisinas se detectan más en América del Sur, el sur de Europa, África y varias partes de Asia. La ocratoxina A tiene mayor prevalencia en el sur de Asia y África. La contaminación por múltiples toxinas es más común en Asia que en Europa o América, probablemente influenciada por el clima, los tipos de muestras y los métodos de prueba (Pinotti et al., 2016).
Aflatoxinas
Las aflatoxinas, las primeras micotoxinas descubiertas, llamaron la atención después de un grave brote de aflatoxicosis llamado «enfermedad X del pavo» en la década de 1960, que provocó la muerte de unos 100.000 pavos. Entre las micotoxinas, las aflatoxinas son las más estudiadas y comprendidas. Las principales aflatoxinas de los cultivos son B1, B2, G1 y G2, producidas principalmente por A. flavus, aunque A. parasiticus y, ocasionalmente, A. nomius también pueden sintetizarlas. Otros hongos filamentosos como Penicillium, Rhizopus, Mucor y Streptomyces también pueden producir aflatoxinas. El precursor de la aflatoxina B1 es la esterigmatocistina, producida principalmente por Aspergillus versicolor y Aspergillus nidulans, pero otras especies de Aspergillus y hongos filamentosos también pueden crearla.
Una amplia gama de ingredientes de piensos, incluidos el maíz, el trigo, las semillas de algodón y las nueces, pueden contaminarse con aflatoxinas. Sin embargo, las principales fuentes de estas toxinas en los piensos para animales son la harina de maní, el maíz y la harina de semilla de algodón. Se ha descubierto que la esterigmatocistina, un precursor de la aflatoxina, contamina ingredientes de piensos como el trigo, el maíz, la cebada y la soja. La contaminación puede ocurrir tanto antes como después de la cosecha, con un mayor riesgo durante condiciones de estrés de las plantas como calor intenso, sequía o infestación de insectos. El almacenamiento inadecuado después de una contaminación por hongos también puede provocar la producción de aflatoxinas. Las temperaturas elevadas (por encima de 27,0 °C), los niveles de humedad (por encima del 62,0 %) y el contenido de humedad del alimento (por encima del 14,0 %) contribuyen a una mayor síntesis de estos metabolitos fúngicos (Russo et al., 2013).
Varios países han establecido regulaciones para los niveles máximos permitidos de micotoxinas en alimentos y piensos, con diferencias que surgen de diversos hábitos dietéticos y consumo de cultivos. En cuanto a las materias primas para piensos, el nivel máximo permitido de aflatoxina B1 es de 0,02 mg/kg, mientras que para los piensos completos (excepto para bovinos, ovinos, caprinos, animales lecheros, terneros, corderos, cerdos y aves de corral, es decir, piensos para peces), es 0,01 mg/kg. No se han establecido regulaciones específicas para la esterigmatocistina.
La aflatoxina B1 es una sustancia altamente cancerígena, conocida por sus efectos nocivos sobre el hígado y otros órganos. Además de ser cancerígeno, presenta efectos genotóxicos e inmunomoduladores en las especies acuáticas. La exposición a la aflatoxina B1 provoca retraso en el crecimiento, anemia, problemas de coagulación sanguínea, daño hepático e inmunosupresión que conduce a susceptibilidad a infecciones y aumento de las tasas de mortalidad (Marijani et al., 2019).
Efectos de las aflatoxinas en especies acuáticas
La aflatoxicosis en acuicultura provoca signos clínicos como branquias pálidas, alteración de la coagulación sanguínea, crecimiento lento y aumento de peso inadecuado. Las infecciones graves pueden provocar tasas de supervivencia reducidas, decoloración del cuerpo (oscurecimiento/coloración amarillenta) y comportamiento anormal, especialmente en especies como la tilapia del Nilo y el esturión juvenil (Marijani et al., 2019). La susceptibilidad de las especies acuáticas a las aflatoxinas varía con la edad y la especie, siendo los alevines más vulnerables que los animales más viejos. La trucha arco iris es muy sensible a las aflatoxinas, y la exposición crónica a niveles bajos aumenta el riesgo de desarrollar cáncer. Incluso a un nivel muy bajo de 0,0004 mg/kg, la trucha arco iris mostró una probabilidad elevada de desarrollar tumores hepáticos después de un tiempo de exposición de entre 8 y 12 meses. La exposición a la aflatoxina B1 también inhibe el sistema inmunológico de las truchas. La LD50 (dosis letal para el 50% de la población) para la trucha arco iris con aflatoxina B1 se determinó en 0,81 mg/kg (Bauer et al., 1969). Otras especies de peces sensibles incluyen la lubina y la corvina roja.
Las especies de aguas cálidas, generalmente, presentan una menor sensibilidad a las aflatoxinas que las especies de agua dulce. El bagre de canal, por ejemplo, tiene una LD50 unas diez veces mayor que la de la trucha arco iris. La tilapia del Nilo también es menos sensible a la aflatoxina B1 en comparación con la trucha arco iris, con una LD50 de 1,0 a 1,3 mg/kg, y su tasa de supervivencia no se ve afectada significativamente por niveles de ingesta de hasta 3,0 mg/kg. Sin embargo, los efectos de la aflatoxina B1 dependen de la dosis y la duración (Deng et al., 2010).
La esterigmatocistina, un compuesto relacionado con las aflatoxinas, causa efectos similares en la salud y afecta principalmente al hígado y los riñones. Es menos tóxico que la aflatoxina, pero provoca problemas como el carcinoma hepatocelular en la trucha arco iris y daños en el ADN, aberraciones cromosómicas, aumento de glóbulos rojos micronucleados y lesiones histopatológicas en la tilapia del Nilo. La exposición a la esterigmatocistina también puede provocar tasas de mortalidad relativamente altas. Tanto las aflatoxinas como la esterigmatocistina pueden bioacumularse en varias especies acuáticas, encontrándose residuos en tejidos como el hepatopáncreas, los ovarios, los músculos, el hígado, entre otros, aunque a menudo en bajas concentraciones. Por ejemplo, se encontró que la lubina tenía aproximadamente 0,005 mg/kg de aflatoxina B1 en su tejido muscular (El-Sayed et al., 2009). Se detectaron residuos de esterigmatocistina en los tejidos comestibles de la tilapia del Nilo en alrededor de 8 µg/kg, pero se considera que la esterigmatocistina plantea un menor riesgo para la salud en comparación con las aflatoxinas.
Fumonisinas
La fumonisina B1 es el tipo más tóxico de fumonisina, producida principalmente por varias especies de Fusarium, siendo Fusarium verticillioides un productor frecuente. Alternaria alternata también puede producir fumonisina B1. Esta micotoxina se encuentra principalmente en el maíz y sus subproductos, con altas tasas de contaminación reportadas en países como Mozambique, Burkina Faso, China y Malasia, donde se ha detectado en entre el 80% y el 100% de las muestras de maíz (Warth et al. , 2012).
Las reglamentaciones sobre los niveles máximos de fumonisinas en los cereales abordan principalmente la contaminación conjunta con fumonisinas B1 y B2. El nivel máximo permitido para el maíz sin procesar (excepto el maíz destinado a la molienda húmeda) es de 4000,0 µg/kg. En los piensos, las fumonisinas no deben exceder los 60,0 mg/kg en el maíz y los productos de maíz, mientras que los piensos completos para acuicultura no deben contener más de 10,0 mg/kg.
Efectos de las fumonisinas en acuicultura
Los efectos de las fumonisinas en las especies acuáticas varían según la especie. El bagre de canal, por ejemplo, muestra una susceptibilidad moderada. Las dosis altas de fumonisina B1 (>320 mg/kg) provocaron cambios histológicos en el hígado, supresión del crecimiento y reducción de la supervivencia, posiblemente debido a una función inmune deteriorada. Las concentraciones de 20,0 mg/kg o más de fumonisina se asociaron con tasas de crecimiento reducidas y alteraciones en el metabolismo de los esfingolípidos, lo que posiblemente afectó la salud celular. La tilapia del Nilo también mostró tasas de crecimiento reducidas y cambios en el metabolismo de los esfingolípidos cuando se expuso a fumonisinas (Tuan et al., 2003).
La carpa común, por otra parte, mostró una alta susceptibilidad al daño inducido por las fumonisinas. La exposición a fumonisina B1 a niveles de 10,0 mg/kg y 100,0 mg/kg durante 42 días provocó daños en los órganos, afectando el hígado, el páncreas, los riñones, el corazón y el cerebro, y provocando daños en los vasos sanguíneos. En particular, el cerebro exhibió cambios histopatológicos y problemas vasculares en carpas jóvenes (Kovacic et al., 2009).
En general, las fumonisinas parecen inducir daño a los órganos, deterioro del sistema inmunológico, reducción del aumento de peso, cambios metabólicos, que pueden provocar cáncer, y aumento de la mortalidad en los animales. No hay informes de acumulación de fumonisinas en los músculos del pescado, lo que sugiere que el consumo de pescado no plantea un riesgo significativo para la seguridad alimentaria en relación con esta toxina.
Ocratoxina
La ocratoxina A, la más tóxica entre las ocratoxinas, es producida principalmente por Penicillium spp. (Penicillium verrucosum) y Aspergillus spp., particularmente Aspergillus ochraceous y Aspergillus carbonarius. La contaminación por ocratoxina A suele producirse después de la cosecha en cereales como el trigo, la cebada, la avena y el maíz, aunque también puede afectar a otros productos básicos. La ocratoxina A es conocida por su estabilidad y resistencia a la eliminación, lo que dificulta su eliminación de los productos alimenticios y le permite persistir a lo largo de la cadena alimentaria.
Las regulaciones de la Comisión Europea han establecido un nivel máximo de 5,0 µg/kg para la ocratoxina A en cereales no procesados y 3,0 µg/kg para todos los productos derivados de cereales no procesados, incluidos los productos de cereales procesados. En los piensos, cereales y productos a base de cereales, el límite de ocratoxina A se fija en 0,25 mg/kg. No se han establecido límites específicos para los piensos completos, excepto para cerdos y aves de corral, posiblemente debido al conocimiento limitado sobre los efectos de las ocratoxinas en otros animales.
Efectos de la ocratoxina A en especies acuáticas
En cuanto a los efectos de la ocratoxina A en las especies acuáticas, hay investigaciones limitadas, pero las especies parecen ser muy sensibles a esta micotoxina. Por ejemplo, la lubina adulta mostró una alta sensibilidad, con una CL50 oral aguda (96 h) de 277,0 µg/kg, lo que provocó manifestaciones nerviosas y respiratorias (El-Sayed et al., 2009). Los bagres juveniles expuestos a ocratoxina A (2,0 mg/kg y más) experimentaron una reducción del aumento de peso corporal, conversión alimenticia, niveles de hematocrito, aumento de la mortalidad y lesiones renales y hepáticas (Manning et al., 2003). Además, los juveniles de bagre de canal expuestos a la ocratoxina A (4 mg/kg) mostraron una mayor mortalidad cuando se infectaron con la bacteria Edwardsiella ictalurid, probablemente debido a una respuesta inmune debilitada causada por la ocratoxina A. En la tilapia del Nilo, la intoxicación por ocratoxina provocó varios efectos, incluidos movimiento lento, menor capacidad de supervivencia, disminución del crecimiento, lesiones renales y hepáticas y disminución de los niveles de proteína total (Diab et al., 2018).
La acumulación de ocratoxina en el músculo del pescado no parece ser significativa en la trucha arco iris y la tilapia del Nilo, y solo se encontraron niveles bajos (media 0,12 µg/kg) de ocratoxina A en el músculo de la lubina y la dorada. Esto sugiere que es posible que el pescado no contribuya significativamente a la presencia de ocratoxina A en la cadena alimentaria.
Tricotecenos
Los tricotecenos son micotoxinas producidas en cultivos como el maíz, el trigo, la cebada y la avena por varios géneros de hongos, incluidos Fusarium, Myrothecium, Phomopsis, Stachybotrys, Trichoderma y Trichothecium. Los dos tricotecenos más importantes que se encuentran en los cultivos son el deoxinivalenol y la toxina T-2. Si bien la toxina T-2 tuvo efectos significativos en la salud de los embriones de pez cebra, no parece representar una amenaza sustancial para las especies acuáticas o la salud humana. Por otro lado, el deoxinivalenol (también conocido como vomitoxina) es producido principalmente por Fusarium spp., particularmente Fusarium graminearum, y es más común en los piensos que en los alimentos en Europa.
En las materias primas para piensos, el nivel máximo de deoxinivalenol en los subproductos del maíz es de 12,0 mg/kg, mientras que para otros cereales y productos de cereales es de 8,0 mg/kg. En los piensos completos y complementarios (excepto determinados animales), el deoxinivalenol no debe superar los 5,0 mg/kg.
Efectos del deoxinivalenol en acuicultura
Los efectos del deoxinivalenol en las especies acuáticas aún no se han estudiado en profundidad. La trucha arco iris parece ser la especie de pez más sensible. Se ha reportado reducciones en la ingesta de alimento, el aumento de peso y en la tasa de crecimiento cuando se expone a dosis de deoxinivalenol de hasta 2,6 mg/kg. Curiosamente, el deoxinivalenol parece tener un efecto protector contra las infecciones bacterianas en algunas especies de peces, como el bagre de canal. En los alevines de salmón del Atlántico, la exposición al deoxinivalenol provocó una reducción del consumo de alimento, aumento de peso, eficiencia alimenticia y alteraciones en los niveles de proteínas y lípidos plasmáticos, lo que potencialmente afectó la función hepática y la integridad intestinal.
Si bien se ha detectado deoxinivalenol en el músculo de la carpa y la trucha arco iris, generalmente se acumula en niveles bajos. La micotoxina generalmente se metaboliza rápidamente y no tiende a acumularse significativamente en los órganos de los animales.
Zearalenona
La zearalenona es producida principalmente por Fusarium spp., incluidos F. graminearum, F. culmorum, F. equiseti y F. crookwellense. La contaminación por estos hongos suele ocurrir antes de la cosecha en cultivos como el maíz. La zearalenona es conocida por su fuerte actividad estrogénica, actuando como un micoestrógeno que afecta las capacidades reproductivas de varios animales.
En las materias primas usadas para alimentación de especies acuáticas, los subproductos del maíz no deben superar los 3,0 mg/kg de zearalenona, mientras que para otros cereales y productos de cereales el límite es de 2,0 mg/kg. Sin embargo, no existen límites establecidos para los piensos completos para animales distintos de los mamíferos.
Efectos de la zearalenona en las especies acuáticas
Los efectos de la zearalenona en la acuicultura no han sido ampliamente estudiados. La trucha arco iris, por ejemplo, puede acumular cantidades relativamente altas de zearalenona en sus ovarios (hasta 7,1 µg/kg), pero el impacto en la reproducción sigue siendo en gran medida desconocido. Se ha demostrado que la exposición a corto plazo del pez cebra a la zearalenona reduce la frecuencia de desove y la fecundidad relativa (Schwartz et al., 2013). Además, la zearalenona en una concentración de 2,0 mg/kg parece aumentar la tasa de crecimiento y la eficiencia alimentaria de la trucha arco iris, pero también puede tener efectos inmunomoduladores que podrían afectar la salud de los peces (Wozny et al., 2019).
Si bien la zearalenona se acumula en los ovarios de la trucha arco iris y se han detectado pequeñas cantidades en el hígado y los intestinos, no parece acumularse significativamente en el tejido muscular de los animales. Por tanto, el consumo de pescado no parece ser una fuente importante de exposición a zearalenona.
Contaminación por múltiples micotoxinas
Los alimentos para especies acuáticas pueden estar expuestos a múltiples micotoxinas debido a la contaminación de las materias primas o a diferentes hongos que producen varias micotoxinas simultáneamente. Esto puede suceder con las especies de Fusarium, que son capaces de producir varias toxinas en los cultivos que infectan. Por ejemplo, el maíz puede estar contaminado tanto con zearalenona como con fumonisinas, o con fumonisinas y tricotecenos. La multi contaminación también puede ocurrir cuando diferentes hongos producen distintas micotoxinas. Un ejemplo es el sorgo, que puede contaminarse tanto con Fusarium como con Aspergillus, lo que provoca la presencia de fumonisina B1 y aflatoxina B1, después de un almacenamiento prolongado.
Los efectos del consumo de piensos y alimentos contaminados con múltiples micotoxinas no han sido ampliamente estudiados hasta la fecha, especialmente en relación con el pescado. Se necesita más investigación, tanto in vitro como in vivo, para comprender de manera integral su impacto biológico. Cuando se ingieren diferentes micotoxinas simultáneamente, pueden interactuar entre sí, lo que puede dar lugar a efectos sinérgicos y/o aditivos, especialmente si sus mecanismos de acción son similares. Por ejemplo, las micotoxinas nefrotóxicas como la ocratoxina A y la citrinina pueden tener efectos sinérgicos cuando se consumen juntas. Del mismo modo, el consumo de diversos tricotecenos, conocidos como inmunosupresores, puede provocar efectos aditivos en diferentes animales. En consecuencia, el pescado contaminado con múltiples micotoxinas podría representar un riesgo particularmente alto para el consumo.
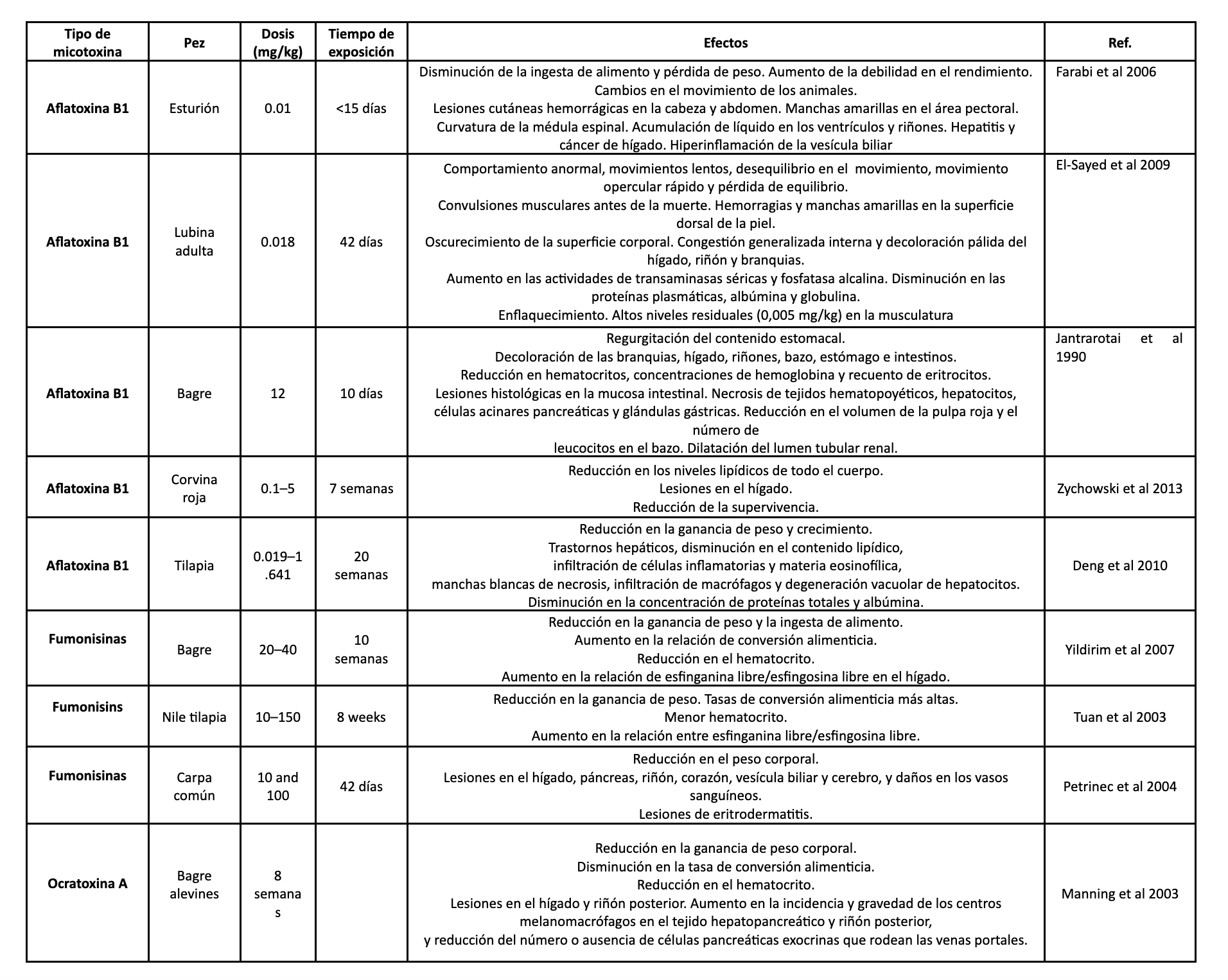
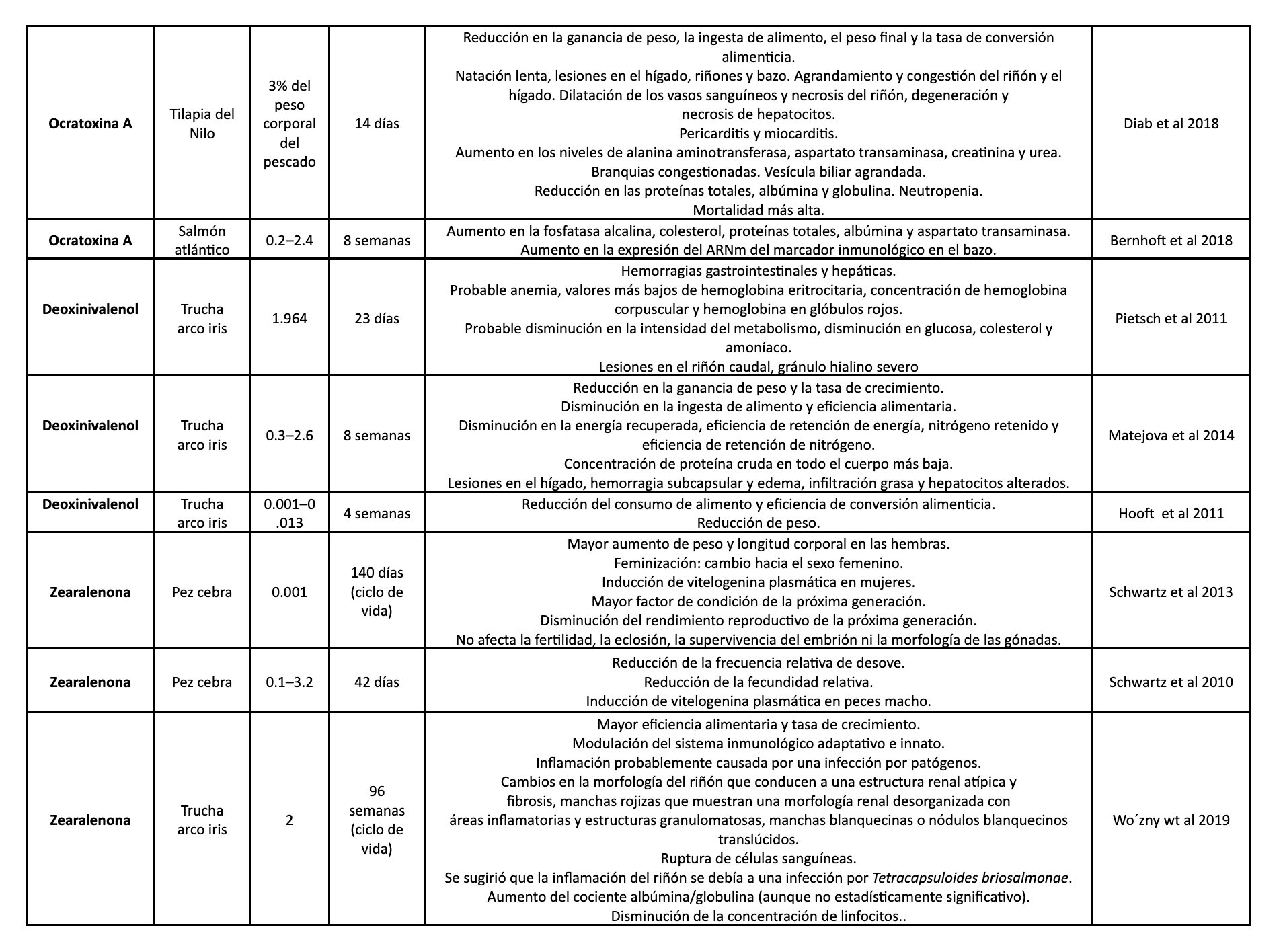
Tabla 1. Se muestran diferentes estudios sobre los efectos de las micotoxinas en diversas especies acuáticas.
Conclusión
El uso de ingredientes de origen vegetal en los alimentos acuícolas plantea riesgos importantes para la acuicultura debido al aumento de la contaminación por micotoxinas. Las especies acuáticas que consumen estos alimentos sufren mayores tasas de enfermedades, mortalidad, problemas reproductivos y un menor aumento de peso, lo que resulta en pérdidas económicas sustanciales. Incluso pequeñas trazas de micotoxinas en el pescado pueden poner en peligro la salud de los consumidores. Esto exacerba la exposición existente a las micotoxinas, especialmente en las regiones de alto consumo de cereales y en los países en desarrollo, lo que podría provocar problemas de salud crónicos como cáncer y sistemas inmunológicos debilitados. En consecuencia, las micotoxinas en los alimentos acuícolas tienen graves consecuencias económicas y de salud pública.
Para combatir este problema, son esenciales estrategias proactivas para el control de la contaminación por micotoxinas antes y después de la cosecha. El monitoreo rutinario de los ingredientes crudos y del alimento terminado debería convertirse en una práctica estándar para garantizar la seguridad y sostenibilidad del crecimiento de la acuicultura en el futuro.



