Introducción
Dentro de la familia de hongos del género Fusarium existen determinadas especies que, por su prevalencia y potenciales efectos micotóxicos, tienen una significativa importancia. Destacan Fusarium verticillioides y Fusarium proliferatum, ya que se encuentra ampliamente distribuidos en varios cultivos, con especial impacto en la producción de maíz a nivel mundial. Su capacidad para infectar distintas estructuras de la planta, como raíces, tallos y mazorca, compromete la calidad y seguridad del grano. Este hongo es productor de varias micotoxinas, entre las que destacan las Fumonisinas, compuestos asociados con efectos adversos en la salud animal y humana (Gai et al., 2018). La síntesis de estas toxinas está regulada por un grupo de genes localizados en el locus FUM, que participan en redes complejas de señalización y regulación genética. Además de su papel en la contaminación de los alimentos, las fumonisinas han sido identificadas como factores de virulencia, ya que influyen en la capacidad del hongo para colonizar los tejidos vegetales. La investigación sobre los mecanismos de regulación de estas toxinas y su interacción con la respuesta de defensa de las plantas es clave para el desarrollo de estrategias de control que minimicen su impacto en la producción agrícola y la seguridad alimentaria.
Rutas de colonización de los patógenos
El Fusarium es un hongo de campo cuya proliferación y producción de micotoxinas tiene lugar, principalmente, durante el cultivo. La colonización por especies de Fusarium puede ocurrir a través de múltiples rutas de entrada. La diversificación es clave para su éxito en la colonización de tejidos y asegurar su supervivencia, lo que afecta gravemente a diversos cultivos, como el maíz (De la Torre-Hernández et al., 2014).
Las principales rutas de infección son:
- Infección sistémica en plántulas: El hongo puede infectar a las plántulas desde la germinación, penetrando directamente en la semilla o a través de las raíces. Aunque la colonización inicial se limita principalmente a las raíces y el mesocotilo, el hongo puede avanzar hacia el tallo, aunque de forma limitada.
- Infección a través del estigma: La vía más común de infección de la mazorca ocurre cuando las esporas del hongo, transportadas por el aire o la lluvia, se depositan en el estigma. Desde allí, el hongo puede crecer y alcanzar los granos, incluso en ausencia de daños mecánicos.
- Infección por daño mecánico: Los insectos plaga del maíz, al alimentarse, pueden dañar los tejidos de la planta, creando puntos de entrada para el hongo. Además, algunos insectos actúan como vectores, transportando las esporas del hongo de una planta a otra.
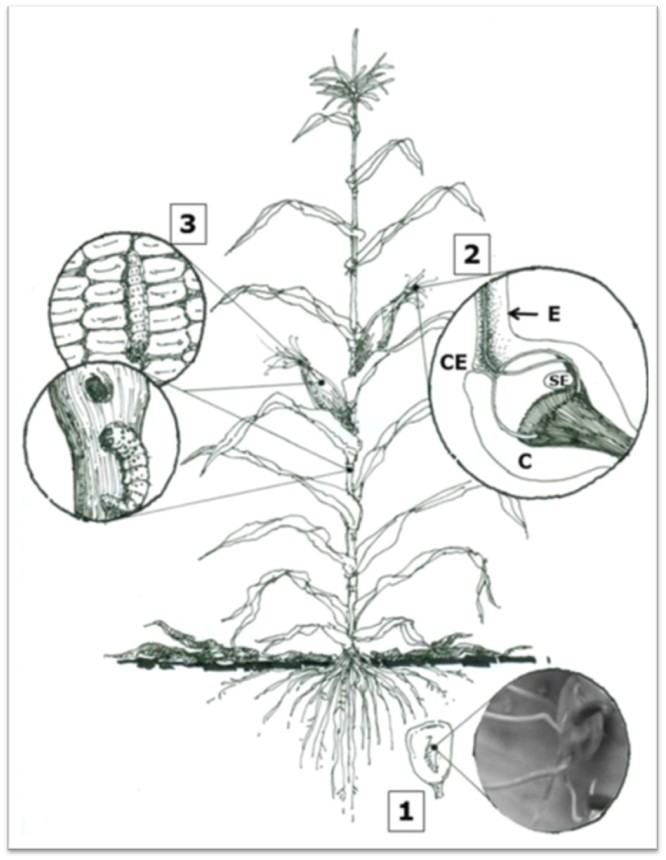
Figura 1. Diferentes rutas de entrada de Fusarium verticillioides a la planta de maíz. 1. Infección sistémica de plántulas 2. Infección a través del estigma. 3. Infección a través de daños mecánicos (De la Torre-Hernández et al., 2014).
La capacidad de Fusarium verticillioides para utilizar múltiples rutas de infección (figura 1), junto con la ayuda de insectos vectores, contribuye a su alta incidencia y severidad en los cultivos. Comprender estas vías de infección es crucial para desarrollar estrategias de control efectivas y proteger la producción de maíz.
Vías metabólicas y síntesis de Fumonisinas
La biosíntesis de las fumonisinas en Fusarium verticillioides está determinada por la secuencia de genes del locus FUM (figura 2). Tal como se muestra en la figura 3, este proceso comienza con la formación de una cadena lineal de policétidos de 18 carbonos, que constituye la estructura base de las fumonisinas. Dicha síntesis se lleva a cabo a partir de acetil-CoA, malonil-CoA y S-adenosil metionina, mediante la acción de la enzima FUM1 (Proctor et al., 1997).
Posteriormente, el gen FUM8, que codifica una α-oxoamina sintasa, cataliza la condensación de la cadena policétida a través de la descarboxilación de aminoácidos y tioésteres de acil-CoA. En esta etapa, se incorporan dos átomos de carbono adicionales provenientes de la alanina, generando un compuesto de 22 carbonos denominado 2-amino-12,16-dimetileicosano-3-ona (Seo et al., 2001).
La enzima FUM13, una deshidrogenasa de cadena corta, reduce el 2-amino-3-oxo-12,16-dimetilicosano (un intermediario cetónico) a 2-amino-3-hidroxi-12,16-dimetilicosano (Yi et al., 2005). Además, las enzimas FUM2 y FUM6 catalizan la hidroxilación en las posiciones C-10, C-14 y C-15 (Desjardins et al., 1996).
En la fase final de la biosíntesis de las fumonisinas, el transportador FUM11 facilita el traslado de precursores del ácido tricarboxílico desde las mitocondrias. Finalmente, las enzimas FUM7 y FUM10 convierten estos precursores en un grupo acetilo, completando así la biosíntesis de las fumonisinas (Kolawole et al., 2021).
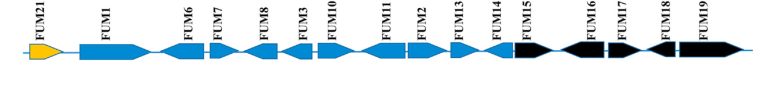
Figura 2. Genes biosintéticos de fumonisinas en Fusarium verticillioides (locus FUM). El gen que regula el grupo se indica con la flecha dorada. Los genes no necesarios para la biosíntesis de fumonisinas se indican con las flechas negras (Butchko et al., 2006; Seo et al., 2001).
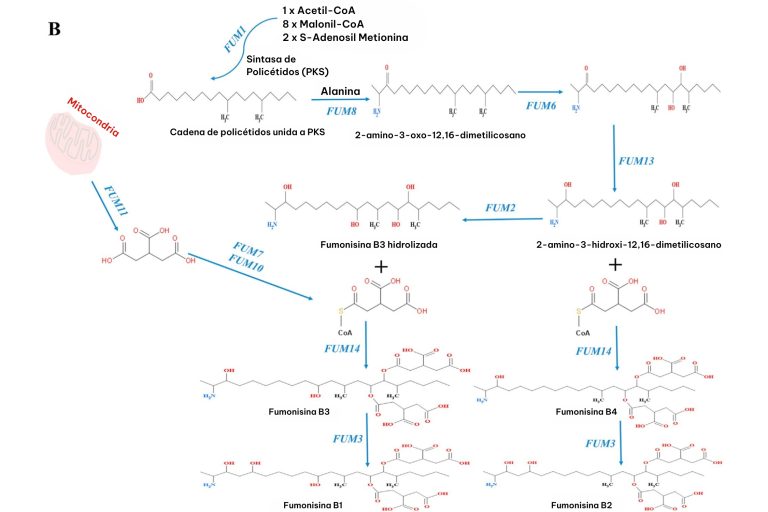
Figura 3. Vías propuestas de biosíntesis de fumonisinas (Butchko et al., 2006; Seo et al., 2001).
Regulación de la biosíntesis
La producción de fumonisinas por distintas cepas de Fusarium verticillioides es altamente variable. Además de las condiciones ambientales, factores como la disponibilidad de agua y nutrientes también influyen en la síntesis de fumonisinas. Asimismo, existen genes ubicados fuera del locus FUM que intervienen en diferentes niveles dentro de las vías de señalización celular. Estos genes desempeñan un papel clave en la activación de los genes del locus FUM, regulando así la producción de fumonisinas (figura 4).
Influencia de las condiciones ambientales
La producción de fumonisinas se ve influenciada por varios factores ambientales y nutricionales. El pH ácido favorece la síntesis de la toxina, mientras que el pH alcalino la inhibe. El gen PAC1 involucrado en la respuesta al pH, actúa como represor. La fuente de nitrógeno también impacta la producción, siendo el amonio un inhibidor, y el gen AREA un regulador positivo de la síntesis de fumonisinas.
Los carbohidratos presentes en el maíz afectan a la producción de micotoxinas, especialmente cuando el hongo crece en amilopectina o dextrina. El gen HXK1, que percibe azúcares, es el encargado de regular la síntesis de fumonisinas, con una disminución del 80% en su ausencia.
El transporte de carbohidratos, regulado por el gen FST1, también es clave para la producción de fumonisinas. Los factores transcripcionales Zfr1 y Sda1 regulan positivamente y negativamente la síntesis, respectivamente. Además, el gen FUM21 también tiene un papel positivo en la producción de la toxina.
En resumen, la síntesis de fumonisinas es modulada por factores ambientales (como el pH) y nutricionales (como fuentes de nitrógeno y los carbohidratos), así como por genes y factores transcripcionales que actúan de forma positiva o negativa. (De la Torre-Hernández et al., 2014)
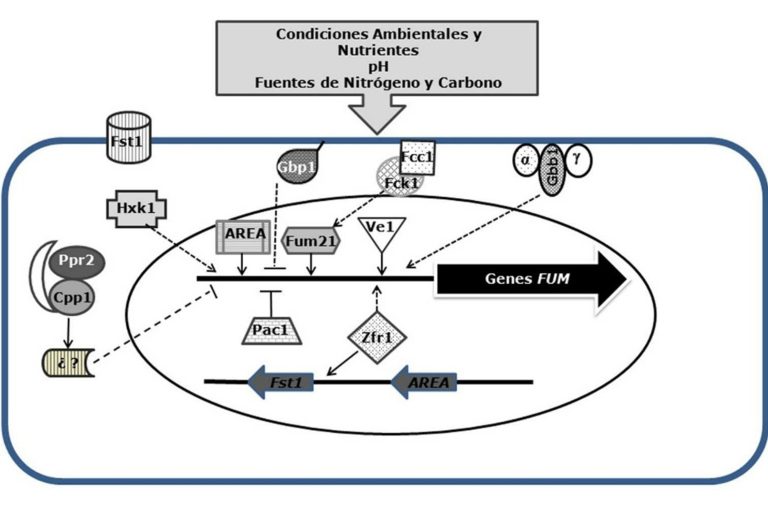
Figura 4. Regulación de la síntesis de fumonisinas. Indicando reguladores positivos y negativos de los genes FUM y localización en la célula. Las flechas continuas indican un efecto positivo mientras que las líneas truncadas un efecto negativo (De la Torre-Hernández et al., 2014).
La producción de fumonisina B1 (FB1) por Fusarium verticillioides está estrechamente relacionado con la virulencia demostrando que su síntesis ocurre desde las primeras etapas de la infección, incluso durante la fase endofítica (Williams, L. D et al., 2006).
La FB1 tiene efectos fitotóxicos, como la reducción del crecimiento de raíces y tallos en plántulas de maíz. También produce la inhibición del crecimiento de tallos en plantas (Williams, L. D et al., 2007).
La capacidad productora de fumonisinas incrementa la capacidad para infectar plántulas de maíz de los hongos, siendo estas más virulentas. Por lo tanto, la síntesis de fumonisinas juega un papel crucial en la virulencia durante la infección de plántulas de maíz, pero no son necesarias para la infección o pudrición de tallos y mazorcas. Las investigaciones sugieren que, aunque las fumonisinas contribuyen a la colonización en las primeras etapas de la infección, su impacto disminuye en etapas posteriores de la enfermedad. Además, debido a su estabilidad química, pueden persistir incluso después de la muerte del hongo.
Interacciones moleculares de las fumonisinas
La fumonisina B1 (FB1) actúa inhibiendo varios blancos moleculares en las células vegetales, lo que contribuye a su virulencia en Fusarium verticillioides infectando cultivos.
A continuación, se detallan los principales blancos moleculares afectados:
- Esfinganina N-acil transferasa: FB1 inhibe esta enzima, que es clave en la biosíntesis de esfingolípidos, causando la acumulación de esfinganina y fitoesfingosina. Esta acumulación altera la membrana celular y activa vías de señalización relacionadas con la muerte celular. En maíz, se observa una mayor acumulación de esfinganina y fitoesfingosina, lo que está relacionado con lesiones necróticas en hojas y la muerte celular, favoreciendo al hongo como saprófito (Merrill et al., 1993).
- ATPasa de H+ de membrana plasmática: Esta enzima es crucial para el mantenimiento del pH y el potencial membranal, los cuales son esenciales para la elongación del tejido. FB1 inhibe la función de ATPasa H+, lo que reduce la elongación radicular y la acidificación del medio, contribuyendo a la inhibición del crecimiento de las plantas (Liu, J et al., 2009).
- β-1,3-glucanasas: Estas enzimas, involucradas en la defensa de las plantas contra hongos, se ven moduladas por FB1. Las fumonisinas inhiben la actividad de las β-1,3-glucanasas básicas (Zitomer N.C et al., 2010), mientras que inducen la actividad de una glucanasa ácida, posiblemente mediada por ácido salicílico (De la Torre-Hernández,M.E. et al. 2010) lo que sugiere una alteración en la respuesta de defensa de la planta (Sánchez-Rangel et al., 2012).
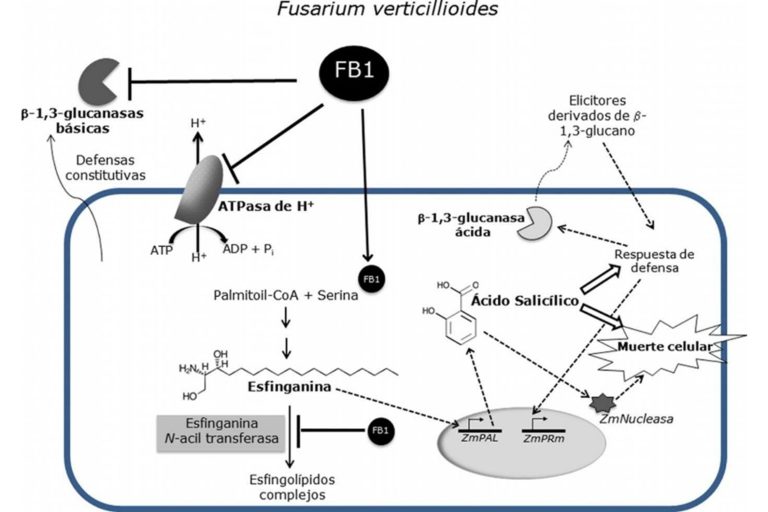
Figura 5. Efectos inhibitorios de las fumonisina B1 en las células vegetales sobre la ATPasa de H+, la esfinganina N-acil transferasa y las β-1,3-glucanasas básicas (De la Torre-Hernández et al., 2014).
En conjunto, estos efectos moleculares contribuyen al daño y la virulencia de Fusarium verticillioides en el maíz, favoreciendo la colonización del hongo en los tejidos vegetales como granos y cereales.
Conclusiones
La síntesis de fumonisinas, especialmente la fumonisina B1, es un factor clave de la virulencia de Fusarium en los cultivos. La FB1 inhibe la biosíntesis de esfingolípidos, alterando el equilibrio de los metabolitos celulares y provocando la muerte celular, lo que favorece la proliferación del hongo en el tejido vegetal y le permite adoptar un comportamiento parasítico.
Además, la FB1 es capaz de inhibir diversas respuestas defensivas de la planta, lo que facilita la colonización e infección y permite al hongo dañar a los cultivos de manera más eficiente. Esto no solo produce importantes pérdidas económicas también representa un riesgo toxicológico para los animales que se alimentan de ellos al acumularse en los granos y cereales. Comprender los mecanismos que regulan su colonización y expresión es clave para optimizar la gestión de los cultivos y minimizar los efectos perjudiciales a lo largo de la cadena alimentaria.


