Más allá de la apoptosis: La singularidad de la ferroptosis
Aunque tradicionalmente se ha puesto el foco en la apoptosis o la necrosis, la ciencia moderna ha identificado un nuevo protagonista en la degradación celular: la ferroptosis. Este proceso se define como una forma de muerte celular programada de tipo no apoptótico, que se distingue de la apoptosis, la necrosis y la autofagia, tanto por sus mecanismos moleculares como por sus características morfológicas (Dixon et al., 2012; Ali et al., 2025; Chen et al., 2025).
Identificada formalmente en 2012, la ferroptosis se describe esencialmente como un proceso letal impulsado por la peroxidación lipídica. A diferencia de otras vías, su diagnóstico se observa principalmente en las mitocondrias, las cuales presentan un encogimiento característico, la reducción o desaparición de sus crestas, la ruptura de su membrana externa y un aumento de la densidad bicapa (Chen et al., 2025; Ding et al., 2023; Fan et al., 2025; He et al., 2024; Huangfu et al., 2025; Søderstrøm et al., 2022; Wang et al., 2024; Wang et al., 2025; Yu et al., 2025).
El fallo de la homeostasis y la peroxidación lipídica
La ferroptosis comienza con una alteración en la homeostasis del hierro, lo que provoca un aumento del hierro ferroso (Fe2+) libre en el citoplasma (Dixon et al., 2024; Zhu et al., 2025). Este exceso de hierro libre desencadena la denominada reacción de Fenton, la cual genera una acumulación masiva de especies reactivas de oxígeno (ERO) que atacan las estructuras de la célula (Guan et al., 2025; Wang et al., 2024; Zhu et al., 2025).
Para que la ferroptosis progrese, es necesario que la célula pierda su capacidad de neutralizar este estrés oxidativo. El mecanismo de defensa más crítico es el eje sistema Xc-/GSH/GPX4 (Ali et al., 2025; Chen et al., 2025). La inhibición del transportador Xc- impide la entrada de cistina, lo que agota los niveles de glutatión (GSH), el principal antioxidante celular (Huangfu et al., 2025; Tian et al., 2025; Zhu et al., 2025). Sin GSH, la enzima glutatión peroxidasa 4 (GPX4) se inactiva o degrada. (Ali et al., 2025; Ding et al., 2023; Zhu et al., 2025).
En ausencia de una defensa antioxidante funcional, los radicales libres y el hierro atacan a los ácidos grasos poliinsaturados (PUFAs) presentes en las membranas celulares y de los orgánulos (Ali et al., 2025; Ding et al., 2023; Dixon et al., 2024). Esta oxidación incontrolada daña la integridad de la membrana, aumentando su tensión y permeabilidad (Ali et al., 2025; Dixon et al., 2024; Fan et al., 2025). Esto provoca la activación de canales iónicos, permitiendo una entrada masiva de calcio (Ca2+) y sodio (Na+), junto con una salida de potasio (K+) (Dixon et al., 2024; Liu et al., 2022). La pérdida de la homeostasis iónica desencadena una entrada de agua por ósmosis, lo que resulta en una hinchazón celular y de los orgánulos (Dixon et al., 2024; He et al., 2024; Søderstrøm et al., 2022).
Al final, todo esto provoca el colapso físico de la célula. La membrana plasmática se rompe, liberando los contenidos intracelulares (Figura 1) (Dixon et al., 2024; Liu et al., 2022; Mou et al., 2019).
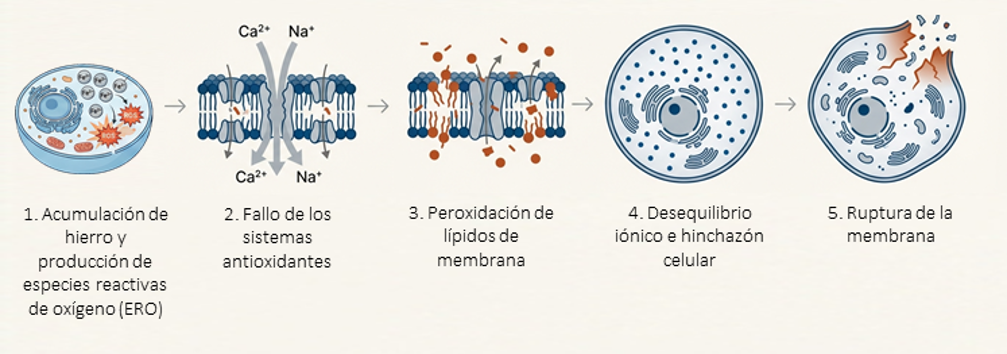
Figura 1. Proceso de ferroptosis.
Micotoxinas: Activadores de la ferroptosis
La activación de la ferroptosis por parte de las micotoxinas responde a una ofensiva coordinada a través de tres vías interconectadas: la disrupción del metabolismo del hierro, el agotamiento del sistema antioxidante GPX4 y la acumulación masiva de peróxidos lipídicos (Zhu et al., 2025). Toxinas como la aflatoxina B1 (AFB1), el deoxinivalenol (DON) y la zearalenona (ZEA) actúan como catalizadores de este proceso, generando niveles de ERO que sobrepasan las defensas naturales de la célula (Ding et al., 2023; Zhu et al., 2025).
Mecanismos de acción específicos
La AFB1 ejerce su toxicidad de dos maneras: por un lado, inhibe la vía de señalización NRF2, provocando una caída drástica del GSH y la inactivación de la enzima GPX4 (Chen et al., 2025; Zhu et al., 2025). Por otro, promueve la ferritinofagia, un proceso de degradación de la ferritina, que libera grandes cantidades de hierro ferroso (Fe2+) al citoplasma, alimentando directamente la reacción de Fenton (Song et al., 2024; Zhu et al., 2025).
En una línea similar, el DON compromete la viabilidad de órganos clave como el hígado, el intestino y los órganos reproductivos al inhibir el eje SLC7A11-GSH-GPX4 (Guan et al., 2025; Zhu et al., 2025). Investigaciones recientes sugieren que su impacto es incluso más profundo, alterando la glucólisis y silenciando, mediante mecanismos epigenéticos, genes cruciales para la homeostasis del hierro (Fan et al., 2025).
Por su parte, la ZEA activa la vía del supresor tumoral p53 para bloquear la entrada de cistina a la célula, lo que impide la síntesis de GSH y deja la membrana celular totalmente expuesta a la peroxidación. (Wang et al., 2025; Xiong et al., 2025; Zhu et al., 2025).
La ocratoxina A (OTA) utiliza la remodelación epigenética para silenciar genes antioxidantes mientras activa aquellos que favorecen la ferroptosis (Ali et al., 2025).
Mientras tanto, la toxina T-2 ataca específicamente la reserva de ferritina y GPX4, causando daños severos en tejidos cardíacos y testiculares (He et al., 2024; Zhu et al., 2025).
Finalmente, la fumonisina B1 (FB1) desencadena este proceso a través de la mitofagia, generando un desequilibrio de hierro mitocondrial que culmina en un aumento letal de las ERO (Figura 2) (Zhu et al., 2025).
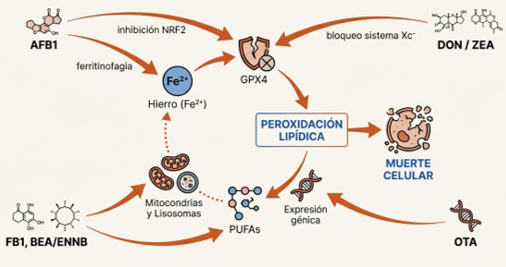
Figura 2. Rutas de acción de las principales micotoxinas.
Del daño celular al impacto productivo y sistémico
La activación de la ferroptosis por micotoxinas no debe entenderse como un evento celular aislado, sino como el detonante de un deterioro sistémico que compromete la rentabilidad y el bienestar animal. Este proceso se manifiesta de forma crítica en los principales ejes de la producción.
Desafíos reproductivos y lesiones en el material hereditario
En la producción porcina, la ZEA induce ferroptosis en las células del estroma endometrial (ESCs) y en los ovarios, comprometiendo la gestación y la salud uterina (Wang et al., 2025; Zhu et al., 2025). En lechones, el DON promueve el daño ovárico al inhibir la glucólisis y la síntesis de hormonas esteroides esenciales como la progesterona y el estradiol (Fan et al., 2025).
En aves, la AFB1 afecta gravemente el crecimiento y desarrollo de las células germinales primordiales (PGCs), reduciendo el potencial reproductivo desde etapas embrionarias (Niu et al., 2025). En machos, toxinas como T-2 y ZEA provocan la degradación de la espermatogénesis y la atrofia testicular (He et al., 2024; Zhu et al., 2025).
Compromiso de la barrera intestinal
El tracto gastrointestinal, primera línea de defensa del organismo, sufre daños estructurales profundos. Micotoxinas como el DON y la citrinina (CTN) provocan el desprendimiento de vellosidades, daño glandular y la disrupción de las uniones estrechas (tight junctions), lo que aumenta la permeabilidad intestinal (Huangfu et al., 2025; Lim et al., 2025; Zhu et al., 2025). Esto deriva en una menor eficiencia alimenticia, diarreas crónicas y una mayor susceptibilidad a patógenos entéricos (Huangfu et al., 2025; Zhu et al., 2025). Además, la co-exposición de DON con metales como el cobre potencia sinérgicamente esta toxicidad intestinal (Zhong et al., 2025).
Nefrotoxicidad y hepatotoxicidad severa
La OTA es un potente nefrotóxico que causa atrofia glomerular e infiltración inflamatoria en pollos de engorde (Tian et al., 2025; Wang et al., 2024). Paralelamente, la AFB1 y el DON desencadenan hepatotoxicidad caracterizada por hemorragias hepáticas, necrosis y una caída drástica en la capacidad de desintoxicación del hígado, afectando directamente la ganancia de peso (Guan et al., 2025; Liu et al., 2025; Zhu et al., 2025).
Inmunosupresión y atrofia linfoide
La ferroptosis inducida por AFB1 afecta órganos linfoides clave como la bolsa de Fabricio en pollos, provocando su atrofia y reduciendo la población de linfocitos (Xia et al., 2024). Esto deja a los animales vulnerables ante desafíos sanitarios del entorno y reduce la eficacia de los programas de vacunación (Xia et al., 2024; Zhu et al., 2025).
Impacto en la acuicultura
En especies como la carpa herbívora, la AFB1 reduce significativamente el consumo de alimento y la tasa de crecimiento específico al inducir ferritinofagia y daño estructural en el hígado (He et al., 2025). Por otro lado, micotoxinas emergentes como la beauvericina (BEA) y las enniatinas (ENNs) también comprometen la viabilidad de los hepatocitos en el salmón del Atlántico, alterando la homeostasis del hierro (Søderstrøm et al., 2022).
Conclusión
La comprensión de la ferroptosis como mecanismo central de la micotoxicosis abre una nueva frontera para la industria de la nutrición animal. Al identificar esta vía, es posible desarrollar estrategias de mitigación mucho más precisas.
El uso de antioxidantes naturales, como la curcumina, ha demostrado una capacidad excepcional para reactivar el eje GPX4, protegiendo la integridad celular frente al ataque de las micotoxinas (Chen et al., 2025; Tian et al., 2025; Wang et al., 2025; Zhu et al., 2025). En última instancia, el control de la ferroptosis no solo mejora el rendimiento productivo, sino que garantiza la seguridad alimentaria y la sostenibilidad de las cadenas de producción animal (Zhu et al., 2025).


